So sánh chất béo và este về thành phần nguyên tố, đặc điểm cấu tạo phân tử và tính chất hóa học.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



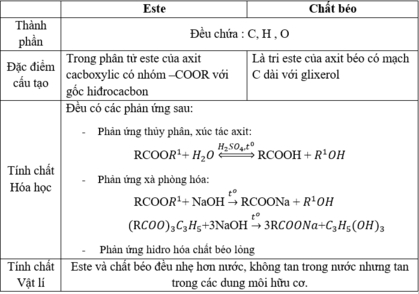
Thành phần nguyên tố
-Chứa C, H, O
Đặc điểm cấu tạo phân tử:
– Là hợp chất este
Tính chất hóa học:
-Phản ứng thủy phân trong môi trường axit
-Phản ứng xà phòng hóa
tham khảo ạ:
Chất béo và Este giống nhau
Thành phần nguyên tố
–Chứa C, H, O
Đặc điểm cấu tạo phân tử:
– Là hợp chất este
Tính chất hóa học:
–Phản ứng thủy phân trong môi trường axit
–Phản ứng xà phòng hóa
Chất béo và Este khác nhau ở đặc điểm cấu tạo nguyên tử

Thành phần nguyên tố:
| Hợp chất hữu cơ | Hợp chất vô cơ |
| - Là những hợp chất có chứa nguyên tố cacbon(trừ CO, O2, muối cacbonat, xianiua, cacbua…) | - Là những chất có thể có cacbon, có thể không hợp chất vô cơ chứa cacbon CO, CO2, muối cacbonat, xianiua, cacbua… |
Đặc điểm liên kết hoá học trong phân tử:
| Hợp chất hữu cơ | Hợp chất vô cơ |
| - Được cấu tạo chủ yếu từ các nguên tố phi kim có độ âm điện khác nhau không nhiều. Thí dụ hay gặp nhất ngoài C là H, O, halogen, S, P… - Liên kết trong hợp chất chủ yếu là liên kết cộng hoá trị. |
- Được cấu tạo chủ yếu từ các nguyên tố kim loại với phi kim. Ví dụ: NaCl, Mg(NO3)2… - Liên kết trong hợp chất chủ yếu là liên kết ion. |

Tham khảo:
Trong phân tử phenol, nhóm –OH liên kết trực tiếp với vòng benzene. Chính nhờ có sự liên kết này, vòng benzene trở thành nhóm hút electron, làm giảm mật độ electron ở nguyên tử oxygen và tăng sự phân cực của liên kết O–H (so với trong phân tử alcohol); đồng thời làm tăng mật độ electron trong vòng benzene, nhất là ở các vị trí ortho và para.
=> Phenol có phản ứng thế nguyên tử H ở nhóm –OH (thể hiện tính acid) và phản ứng thế nguyên tử H của vòng benzene.

a) A có 8 electron, 8 proton
b) Câu hình e: 1s22s22p4
=> A có 6e lớp ngoài cùng
=> A có tính chất của phi kim
c)
- A là O (oxi)
- Trong chu kì 2, 2 nguyên tố lân cận với O là N, F
Trong 1 chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim tăng dần
=> N < O < F (Xét theo tính phi kim)
- Trong nhóm VIA, nguyên tố lân cận với O là S
Trong 1 nhóm A, theo chiều tăng điện tích hạt nhân, tính phi kim giảm dần
=> O > S (Xét theo tính phi kim)
a: Do A có Z=8 nên A là oxi
Cấu tạo nguyên tử là \(O=O\)
b: Tính chất hóa học đặc trưng là tính phi kim, có tính oxi hóa mạnh

a) Cấu tạo nguyên tử và cấu tạo phân tử.
- Giống nhau
+ Sô e ngoài cùng có 7 e. Ở trạng thái cơ bản, nguyên tử halogen đều có 1 electron độc thân.
+ Phân tử 2 nguyên tử, liên kết cộng hóa trị không cực.
+ Cấu hình e lớp ngoài cùng ns2 np5
- Khác nhau:
+ Bán kính nguyên tử tăng dần từ flo đến iot.
+ Số lớp e tăng dần từ flo đến iot.
+ Lớp ngoài cùng của nguyên tố flo là lớp thứ 2 nên không cvaó phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống.
+ Ở trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3,5 hoặc 7 e độc thân.
+ Độ âm điện giảm dần từ flo đến iot.
b) Tính chất vật lí
Trong nhóm halogen, tính chất vật lí biến đổi có quy luật:
Trạng thái tập hợp, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi, …
Từ flo đến iot ta nhận thấy
- Trạng thái tập hợp: từ thể khí chuyển sang thể lỏng và thể khí.
- Màu sắc: đậm dần.
- Nhiệt độ nóng chảy, và nhiệt độ sôi: tăng dần.
- Flo không tan trong nước vì nó phân hủy nước rất mạnh, các halogen khác tan tương đối ít trong nước và tan nhiều trong một số dung môi hữu cơ.
c) Tính chất hóa học.
Giống nhau:
- Vì lớp e lớp ngoài cùng có cấu tao tương tự nhau nên các halogen rất giống nhau về tính chất hóa học của đơn chất cũng như về thành phần và tính chất của các hợp chất.
- Halogen có ái lực với e lớn. Nguyên tử halogen X với 7 e lớp ngoài cùng dễ dàng thu thêm 1 e để trở thành ion âm
X + 1e → X-
- Oxi hóa được hầu hết các kim loại tạo muối halogenua.
Khác nhau:
- Khả năng oxi hóa của các halogen giảm dần từ flo đến iot
- Phản ứng với kim loại , với hidro, với nước của các halogen cũng có khác nhau.
- Flo không thể hiện tính khử không có số oxi hóa dương , còn các halogen khác có tính khử và tính khử tăng dần từ flo đến iot.
chúc chị học tốt ![]()