Alà ddHCl là 0,3 mol, B là dd HCl là 0,6 mol
a) Trộn A và B theo tỉ lệ thể tích VA/VB (=) 2/3 thì được dd C. Tính CMC=?
b) Phải trộn A và B theo tỉ lệ nào vì thể tích để thu được dd D có nồng độ mol = 0,4 (mol)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Coi V A = 2(lít) => V B = 3(lít)
Trong dung dịch C, ta có :
V C = V A + V B = 2 + 3 = 5(lít)
n H2SO4 = n H2SO4(trong A) + n H2SO4(trong B) = 2.0,2 + 3.0,5 = 1,9(mol)
Suy ra :
CM H2SO4 = 1,9/5 = 0,38M
b)
Sau khi trộn :
V C = V A + V B
n H2SO4 = 0,2V A + 0,5V B
Suy ra :
CM H2SO4 = (0,2V A + 0,5V B)/(V A + V B ) = 0,3
<=> 0,2V A + 0,5V B = 0,3V A + 0,3V B
<=> 0,1V A = 0,2V B
<=> V A / V B = 0,2/0,1 = 2 / 1
Vậy phải trộn A và B theo tỉ lệ 2 : 1 về thể tích
\(GS:\)
\(V_A=2\left(l\right),V_B=3\left(l\right)\)
\(n_{H_2SO_4\left(1\right)}=0.2\cdot2=0.4\left(mol\right)\)
\(n_{H_2SO_4\left(2\right)}=0.5\cdot3=1.5\left(mol\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.4+1.5}{2+3}=0.38\left(M\right)\)
\(b.\)
\(V_{H_2SO_4\left(1\right)}=a\left(l\right)\)
\(V_{H_2SO_4\left(2\right)}=b\left(l\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2a+0.5b}{a+b}=0.3\left(M\right)\)
\(\Leftrightarrow0.2a+0.5b-0.3a-0.3b=0\)
\(\Leftrightarrow0.2b=0.1a\)
\(\Leftrightarrow\dfrac{a}{b}=\dfrac{0.2}{0.1}=2\)

\(a) V_A = 2(lít) \to V_B = 3(lít)\\ \Rightarrow V_{dd} = 2 + 3 = 5(lít)\\ n_{H_2SO_4\ trong\ C} = 0,2.2 + 0,5.3 = 1,9(mol)\\ C_{M_{H_2SO_4}} = \dfrac{1,9}{5} = 0,38M\)

đặt nồng độ mol của dd a là a , dd b la b. khi trộn 3 l a (có 3a mol) với 2 lit b (có 2b mol) được 5 lit dd x có dư axit. trung hoà 5 lit dd x cần
nKOH =0,2.5 = 1mol -> số mol H2SO4 dư: 0,5 mol.
H2SO4+ 2KOH -> K2SO4 +2 H2O
b-------------- 2b
số mol h2so4 dư = 3a – b = 0,5*
trộn 2l dd a (có 2a mol) với 3 lít ddb (có 3b mol) tạo 5 l dd y có koh dư. trung hoà 5 lit y cần 0,2 .5 = 1 mol hcl
pt: H2SO4 + 2KOH -> K2SO4 + 2H2O
2a---------------- 4a
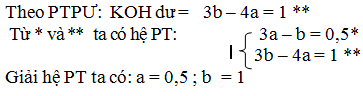

a) Ta có: VA:VB = 2:3
Số mol H2SO4 có trong 2V dung dịch A:
Số mol H2SO4 có trong 3V dung dịch B:
Nồng độ mol của dung dịch H2SO4 sau khi pha trộn:
Vậy nồng độ mol của dung dịch C là 0,38M.
b) Pha chế dung dịch H2SO4 0,3M.
Gọi x(ml) là thể tích của dung dịch axit A.
y(ml) là thể tích của dung dịch B.
→ x = 2y . Vậy nêu y = 1 và x = 2.
Vậy ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H2SO4 có CM = 0,3M.

gọi số mol của NaOH = x , Ba(OH)2 = y . số mol OH- = x + 2y
pt : H+ + OH- → H2O
nH+ =2. 0,035. 2=0,14 mol = x+ 2y
khối lượng kết tủa = mSO42- + mBa2+ = 96.0.07 + 137.y= 9,32 =>y=0,02 => x= 0,1
nồng độ tự tính.

Ta có: V A : V B = 2:3
Số mol H 2 S O 4 có trong 2V (l) dung dịch A:
n H 2 S O 4 = C M . V A = 0,2 . 2V = 0,4V (mol)
Số mol H 2 S O 4 có trong 3V (l) dung dịch B:
n H 2 S O 4 = C M . V B = 0,5 . 3V = 1,5V (mol)
Nồng độ mol của dung dịch H 2 S O 4 sau khi pha trộn:
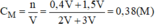
Vậy nồng độ mol của dung dịch C là 0,38M.
Xem lại câu a thử có nhầm không nhé bạn