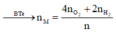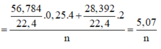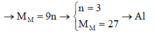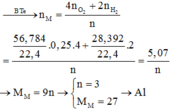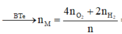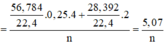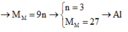Cho 19,2 gam kim loại M ( có hoá trị duy nhất ) vào bình kín có dung tích không đổi chứa 24 gam khí oxi . Nung nóng bình một thời gian rồi đưa vế nhiệt độ ban đầu thấy lượng oxi giảm còn 60% so với ban đầu . Lấy chất rắn trong bình rồi hoà tan bằng dung dịch axit HC1 dư thấy thoát ra 4,48 lít khí \(^H2\) ( đo ở đktc ) . Xác định kim loại M và hiệu suất của phản ứng giữa M và oxi . Biết oxit bazơ tác dụng với dung dịch axit tạo thành muối và nước
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n O2 pư= 0,9 - 0,865 = 0,035 mol
=> mkim loại = m chất rắn - m oxi pư = 2,12 - 0,035.32 = 2,05 (g)

a. Các phương trình có thể xảy ra:
C + O2 → t ∘ CO2 (1)
CaCO3 → t ∘ CaO + CO2 (2)
MgCO3 → t ∘ MgO + CO2 (3)
CuCO3 → t ∘ CuO + CO2 (4)
C +CO2 → t ∘ 2CO (5)
C + 2CuO → t ∘ 2Cu + CO2 (6)
CO + CuO → t ∘ Cu + CO2 (7)
CaO + 2HCl →CaCl2 + H2O (8)
MgO + 2HCl →MgCl2 + H2O (9)
CuO + 2HCl →CuCl2 + H2O (10)
b. Vì sau phản ứng có CO và CO2, các phản ứng xảy ra hoàn toàn nên các chất còn lại sau khi nung là CaO, MgO và Cu không có phản ứng (10)
mCu = 3,2(g) => mCuCO3 = 6,2g
Gọi số mol CaCO3, MgCO3, C trong hỗn hợp lần lượt là a, b, c.(*)
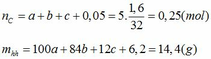
Giải ( *), (**), (***) ta được a=0,025; b=0,05; c=0,125.
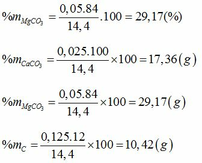

\(n_{O_2\left(pư\right)}=\dfrac{1.3,5}{100}=0,035\left(mol\right)\)
=> m = 2,12 - 0,035.32 = 1 (g)
nO2 (phản ứng) = 1 . 3,5% = 0,035 (mol)
mO2 (phản ứng) = 0,035 . 32 = 1,12 (g)
Áp dụng ĐLBTKL, ta có:
mkl + mO2 = moxit
=> mol = 2,12 - 1,12 = 1 (g)