Cho 68,7 g Al, Fe, Cu tan hết trong HNO3 đặc, sau phản ứng thu được 26,88 lít NO2 ở đktc và m gam chất rắn khan. Tổng khối lượng muối thu được sau phản ứng?
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

17 tháng 1 2018
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D
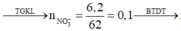
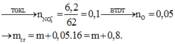


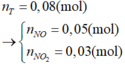
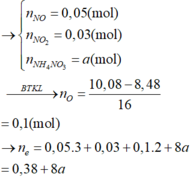


Ta có: \(n_{NO_2}=\dfrac{26,88}{22,4}=1,2\left(mol\right)\)
Bảo toàn electron: \(n_{e\left(trao.đổi\right)}=n_{NO_2}=1,2\left(mol\right)=n_{NO_3^-\left(trong.muối\right)}\)
\(\Rightarrow m_{muối}=m_{KL}+m_{NO_3^-\left(trong.muối\right)}=68,7+1,2\cdot62=143,1\left(g\right)\)
phải là m(g) muối khan chứ ? sao là chất rắn khan, Al, Fe, Cu đều tác dụng HNO3 hết mà?