!!!!!!!!!!!!
Hỗn hợp A gồm 2 kim loại Mg và Zn. B là dung dịch H2SO4 có nồng độ mol là x mol/l
- Trường hợp 1: Cho 24,3g (a) vào 2 lít (B) sinh ra 8,96 lít khí H2
- Trường hợp 2: Cho 24,3g (a) vào 3 lít (B) sinh ra 11,2 lít khí H2
(Các thể tích khí đều đo ở đktc)
a/ Chứng minh trong trường hợp 1 thì hỗn hợp kim loại chưa tan hết, trong trường hợp 2 axit còn dư
b/ Tính nồng độ x mol/l của dung dịch (B) và % khối lượng mỗi kim loại trong (A)

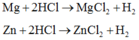

a/ Ta nhận xét thấy Mg và Zn cùng hóa trị nên thể tích H2 tạo ra nhiều nhất khi hỗn hợp chỉ có Mg còn tạo ra ít nhất khi hỗn hợp chỉ có Zn.
TH1: Giả sử kim loại tan hết
\(Zn\left(y\right)+H_2SO_4\rightarrow ZnSO_4+H_2\left(y\right)\)
\(Mg\left(x\right)+H_2SO_4\rightarrow MgSO_4+H_2\left(x\right)\)
Gọi số mol của Mg, Zn lần lược là x, y
Ta có: \(24x+65y=24,3\left(1\right)\)
\(n_{H_2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow x+y=0,4\left(2\right)\)
Từ (1) và (2) ta có hệ: \(\left\{\begin{matrix}24x+65y=24,3\\x+y=0,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=\frac{17}{410}\\y=\frac{147}{410}\end{matrix}\right.\)
Từ đây ta thấy đề sai
Ở chỗ tìm số mol H2 bạn bị làm nhầm rồi. Đáng lẽ phải là \(\dfrac{11,2}{22,4}\)mới ra kết quả đúng !!