cho 3,87 g hỗn hợp gồm Mg và Al tác dụng với 500ml đ HCl 1M a) chứng minhh rằng sau phản ứng với Mg và Al axit vẫn còn dư b) Nếu phản ứng trên thoát ra 4,368 lít khí H2 (đktc) hãy tính số gam Mg và Al đã dùng ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Giả sử hỗn hợp chỉ có Mg.
\(n_{Mg}=\dfrac{3,87}{24}=0,16125mol\)
\(n_{HCl}=0,5\cdot1=0,5mol>n_{Mg}\)
\(\Rightarrow\)Axit còn dư.
b)\(n_{H_2}=\dfrac{4,368}{22,4}=0,195mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x x x x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
y 3y y 1,5y
\(\Rightarrow\left\{{}\begin{matrix}24x+27y=3,87\\x+1,5y=0,195\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,06mol\\y=0,09mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Mg}=1,44g\\m_{Al}=2,43g\end{matrix}\right.\)

a/ Mg(x)+2HCl→MgCl2+H2(x)Mg(x)+2HCl→MgCl2+H2(x)
2Al(y)+6HCl→2AlCl3+3H2(1,5y)2Al(y)+6HCl→2AlCl3+3H2(1,5y)
Giả sử kim loại chỉ có mình Al thì:
nAl=3,8727=43300(mol)nAl=3,8727=43300(mol)
⇒nHCl=43.6300.2=0,43<0,5=nHCl⇒nHCl=43.6300.2=0,43<0,5=nHCl
Giả sử kim loại chỉ có Mg thì
nMg=3,8724=0,16125(mol)nMg=3,8724=0,16125(mol)
⇒nHCl=2.0,16125=0,3225<0,5=nHCl⇒nHCl=2.0,16125=0,3225<0,5=nHCl
Vậy kim loại phản ứng hết HCl dư.
b/ Gọi số mol của Mg và Al lần lược là x, y
⇒24x+27y=3,87(1)⇒24x+27y=3,87(1)
nH2=4,36822,4=0,195(mol)nH2=4,36822,4=0,195(mol)
⇒x+1,5y=0,195(2)⇒x+1,5y=0,195(2)
Từ (1) và (2) ta có hệ: {24x+27y=3,87x+1,5y=0,195{24x+27y=3,87x+1,5y=0,195
⇔{x=0,06y=0,09⇔{x=0,06y=0,09
⇒mMg=0,06.24=1,44(g)⇒mMg=0,06.24=1,44(g)
⇒mAl=0,09.27=2,43(g)

\(n_{H_2SO_4}=0,5\cdot1=0,5mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x x x x
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 1,5y 0,5y 1,5y
\(\Rightarrow\left\{{}\begin{matrix}24x+27y=7,8\\x+1,5y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-\dfrac{1}{2}\left(n_oâm\right)\\y=\dfrac{7}{15}\end{matrix}\right.\)
Em kiểm tra lại đề nha!!!

a, Giả sử hỗn hợp chỉ chứa Mg. $\Rightarrow n_{hh}< 0,1575(mol)$
$\Rightarrow n_{HCl}< 0,315< 0,5(mol)$
Do đó sau phản ứng axit còn dư
b, Gọi số mol Mg và Al lần lượt là a;b(mol)
$\Rightarrow 24a+27b=3,78$
Bảo toàn e ta có: $2a+3b=0,39$
Giải hệ ta được $a=0,045;b=0,1$
$\Rightarrow m_{Mg}=1,08(g);m_{Al}=2,7(g)$

a.Ta có n HCl = 1 . 0,25 = 0,25 mol
nH2SO4 = 0,5.0.25 = 0,125 mol
==> nH(X) = 0,25 + 0,125.2 = 0,5 mol
nH2 = 4,368/22,4 = 0,195 mol <=> nH= 0,195. 2 = 0,39 mol < 0,5 mol
Vậy sau phản ứng dung dịch B vẫn còn axit dư
b. Gọi số mol của Al và Mg lần lượt là x và y mol
Ta có phương trình 27x + 24y =3,87 (1)
Áp dụng định luật bảo toàn eletron ==> 3x + 2y = 0,195.2 (2)
Từ (1) , (2) ==> \(\left\{{}\begin{matrix}x=0,09\\y=0,06\end{matrix}\right.\)
mAl = 0,09 .27 = 2,43 gam , %mAl trong A = \(\dfrac{2,43}{3,87}\).100=62,8%
==> %mMg trong A = 100 - 62,8 = 37,2%

a/ Mg(x)+2HCl→MgCl2+H2(x)Mg(x)+2HCl→MgCl2+H2(x)
2Al(y)+6HCl→2AlCl3+3H2(1,5y)2Al(y)+6HCl→2AlCl3+3H2(1,5y)
Giả sử kim loại chỉ có mình Al thì:
nAl=3,8727=43300(mol)nAl=3,8727=43300(mol)
⇒nHCl=43.6300.2=0,43<0,5=nHCl⇒nHCl=43.6300.2=0,43<0,5=nHCl
Giả sử kim loại chỉ có Mg thì
nMg=3,8724=0,16125(mol)nMg=3,8724=0,16125(mol)
⇒nHCl=2.0,16125=0,3225<0,5=nHCl⇒nHCl=2.0,16125=0,3225<0,5=nHCl
Vậy kim loại phản ứng hết HCl dư.
b/ Gọi số mol của Mg và Al lần lược là x, y
⇒24x+27y=3,87(1)⇒24x+27y=3,87(1)
nH2=4,36822,4=0,195(mol)nH2=4,36822,4=0,195(mol)
⇒x+1,5y=0,195(2)⇒x+1,5y=0,195(2)
Từ (1) và (2) ta có hệ: {24x+27y=3,87x+1,5y=0,195{24x+27y=3,87x+1,5y=0,195
⇔{x=0,06y=0,09⇔{x=0,06y=0,09
⇒mMg=0,06.24=1,44(g)⇒mMg=0,06.24=1,44(g)
⇒mAl=0,09.27=2,43(g)

Sửa đề: 1. Cho 8,4 gam hỗn hợp Zn và Mg tác dụng với 3,65 g HCl
a. Chứng minh rằng axit sau phản ứng vẫn còn dư ?
b. Nếu thoát ra 4,48 lít khí ở (đktc). Hãy tính số gam Mg và Zn đã dùng ban đầu?
--------------------------------------------------------------------------------
Đặt CTHH chung của Mg và Zn là M ( vì chúng cùng hoá trị II )
Ta có : \(M_{Zn+Mg}=89\left(\dfrac{g}{mol}\right)\)(1)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
\(M\left(0,05\right)+2HCl\left(0,1\right)-->MCl2+H2\)
\(\Rightarrow\overline{M_M}=\dfrac{m}{n}=\dfrac{8,4}{0,05}=168\) (2)
Vì (1), hiển nhiên đúng nên (2) vô lí : \(=>HCl.dư\)
b,
Gọi x và y lần lượt là số mol của Zn và Mg trong hỗn hợp :
⇒ 65x + 24y = 8,4 (1)
Do HCl dư nên ta ko quan tâm tới số mol HCl ta có :
\(Zn\left(x\right)=>H_2\left(x\right)\)
\(Mg\left(y\right)=>H_2\left(y\right)\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(=>x+y=0,2\left(2\right)\)
Giải hệ ( 1),(2) có :
\(x=\dfrac{18}{205}=n_{Zn};y=\dfrac{23}{205}=n_{Mg}\)
\(=>m_{Zn}=\dfrac{18}{205}.65=5,7\left(g\right)\)
\(n_{Mg}=\dfrac{23}{205}.24=2,7\left(g\right)\).
Xin hỏi tự nhiên đề có Zn,Mg mà sao câu b lại tính g Mg,Al => Đề sai bết

Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
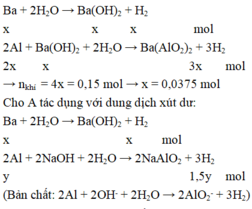

Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B
a/ \(Mg\left(x\right)+2HCl\rightarrow MgCl_2+H_2\left(x\right)\)
\(2Al\left(y\right)+6HCl\rightarrow2AlCl_3+3H_2\left(1,5y\right)\)
Giả sử kim loại chỉ có mình Al thì:
\(n_{Al}=\frac{3,87}{27}=\frac{43}{300}\left(mol\right)\)
\(\Rightarrow n_{HCl}=\frac{43.6}{300.2}=0,43< 0,5=n_{HCl}\)
Giả sử kim loại chỉ có Mg thì
\(n_{Mg}=\frac{3,87}{24}=0,16125\left(mol\right)\)
\(\Rightarrow n_{HCl}=2.0,16125=0,3225< 0,5=n_{HCl}\)
Vậy kim loại phản ứng hết HCl dư.
b/ Gọi số mol của Mg và Al lần lược là x, y
\(\Rightarrow24x+27y=3,87\left(1\right)\)
\(n_{H_2}=\frac{4,368}{22,4}=0,195\left(mol\right)\)
\(\Rightarrow x+1,5y=0,195\left(2\right)\)
Từ (1) và (2) ta có hệ: \(\left\{\begin{matrix}24x+27y=3,87\\x+1,5y=0,195\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=0,06\\y=0,09\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,06.24=1,44\left(g\right)\)
\(\Rightarrow m_{Al}=0,09.27=2,43\left(g\right)\)
bạn ơi,cho mik hỏi ngu một tí.Làm sao bạn tính đc x và y? Làm cách nào ra thế,chỉ mik vs!