Một dung dịch A chứa Ba(OH)2 có pH=13 trộn lẫn với dung dịch B chứa HCl có pH=2. Khi phản ứng xong thu được dung dịch C có pH=12. a) Tính tỉ lệ thể tích của dung dịch A với dung dịch B, cho biết sự trộn lẫn dung dịch không làm thay đổi thể tích dung dịch. b) Hỏi sau khi cô cạn 550 ml dung dịch C thì thu được bao nhiêu gam chất rắn khan, tính % khối lượng chất rắn khan
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Dung dịch sau khi trộn có pH =7 ⇒ nOH- = nH+
⇒ 2a.0,1 + 0,2.0,1 = 0,5.0,12 + 0,25.2.0,12
⇒ a = 0,5
Đáp án B.

1. nNa=nNaOH=a mol
nBa=nBa(OH)2=2a mol
=>nOH-=nNaOH + 2nBa(OH)2=5a mol (1)
pH =12=>pOH=2=> [OH-]=0,01M
=>nOH-=1,5*0.01 (2)
Từ (1) (2) => 1,5*0,01=5a => a=>nNa,nBa=>mNa,mBa

Đáp án B
nH+ ban đầu = 0,1.2.0,1 + 0,2.0,1 + 0,3.0,1 = 0,07
dung dịch C có pH=1 ⇒ nH+/C = 0,1.(0,3 + V)
⇒ nH+ ban đầu = nH+/C + nOH- ⇒ 0,07 = 0,1.(0,3 + V) + 0,2V +0,1.2V
⇒ V =0,08l

Đáp án : A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13

Chọn đáp án B
n H C l =1 V A ; n H N O 3 = 1 V A ; n H 2 S O 4 =1 V A → n H + =4 V A
n K O H = 1 V A ; n N a O H = 2 V B → n O H - = 3 V B
Để thu được dung dịch có pH= 7 thì n H + = n O H -
→ 4 V A = 3 V B → V A : V B = 3 : 4

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)
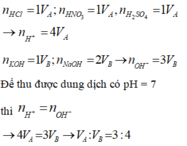
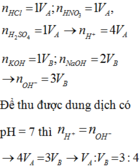
a, \(n_{OH^-}=10^{-1}.V_A\left(mol\right)\)
\(n_{H^+}=10^{-2}.V_B\left(mol\right)\)
\(n_{OH^-dư}=10^{-2}.\left(V_A+V_B\right)\left(mol\right)\)
Ta có: \(n_{OH^-}-n_{OH^-dư}=n_{H^+}\)
\(\Leftrightarrow10^{-1}.V_A-10^{-2}.\left(V_A+V_B\right)=10^{-2}.V_B\)
\(\Leftrightarrow0,09V_A=0,02V_B\)
\(\Rightarrow\dfrac{V_A}{V_B}=\dfrac{2}{9}\)
b, Ta có: \(\left\{{}\begin{matrix}V_A+V_B=0,55\\\dfrac{V_A}{V_B}=\dfrac{2}{9}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}V_A=0,1\left(l\right)\\V_B=0,45\left(l\right)\end{matrix}\right.\)
\(n_{BaCl_2}=\dfrac{1}{2}n_{Cl^-}=\dfrac{1}{2}n_{H^+}=\dfrac{1}{2}.10^{-2}.0,1=0,0005\left(mol\right)\Rightarrow m_{BaCl_2}=0,104\left(g\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{OH^-dư}=\dfrac{1}{2}.10^{-2}.0,55=0,00275\left(mol\right)\Rightarrow m_{Ba\left(OH\right)_2}=0,047025\left(g\right)\)
\(\Rightarrow\%m_{Ba\left(OH\right)_2}=\dfrac{0,047025}{0,047025+0,104}.100\%=31,14\%\)
\(\Rightarrow\%m_{BaCl_2}=62,86\%\)