cho hỗn hợp gồm 75% Fe2O3 và 25% CUO người ta dùng H2 dư để khử 16g hỗn hợp đó. Tính khối lượng sắt và Cu thu được sau phản ứng. Tính thể tích H2 thu được sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{Fe_2O_3}=16\cdot75\%=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0.075\left(mol\right)\)
\(n_{CuO}=16\cdot25\%=4\left(g\right)\)
\(n_{CuO}=\dfrac{4}{80}=0.05\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(n_{H_2}=3\cdot0.075+0.05=0.275\left(mol\right)\)
a,\(m_{Fe_2O_3}=16.75\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=16-12=4\left(g\right)\Rightarrow n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 0,075 0,225 0,15
PTHH: CuO + H2 → Cu + H2O
Mol: 0,05 0,05 0,05
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right);m_{Cu}=0,05.64=3,2\left(g\right)\)
b,\(n_{H_2}=0,225+0,05=0,275\left(mol\right)\)

\(a) n_{Fe_2O_3} = \dfrac{16.75\%}{160} = 0,075(mol)\\ n_{CuO} = \dfrac{16.25\%}{80} = 0,05(mol)\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{Fe} = 2n_{Fe_2O_3} = 0,15(mol) \Rightarrow m_{Fe} = 0,15.56 = 8,4(gam)\\ n_{Cu} = n_{CuO} = 0,05(mol) \Rightarrow m_{Cu} = 0,05.64 = 3,2(gam)\\ b) n_{H_2} = 3n_{Fe_2O_3} + n_{CuO} = 0,075.3 + 0,05 = 0,275(mol)\\ V_{H_2} = 0,275.22,4 = 6,16(lít)\)

hỗn hợp 100% <=> 20g
1. fe2o3 60% <=> 12g <=> 0,075mol
cuo 40% <=> 8g <=> 0,1 mol
Ta có:
Fe2O3 + 3H2 --> 2Fe + 3H2O
mol: 0,075 0,225 0,15
CuO + H2 → Cu + H20
mol: 0.1 0.1 0.1
mFe= 0,15x56=8,4g. mCu=0,1x64= 6,4g
nH2= 0,225+0,1=0,325mol ==> V H2 = 0,325x 22,4 = 7,28 lít

a, mFe2O3 = 32 . 75% = 24 (g)
nFe2O3 = 24/160 = 0,15 (mol)
mCuO = 32 - 24 = 8 (g)
nCuO = 8/80 = 0,1 (mol)
PTHH:
Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
0,15 ---> 0,45 ---> 0,3
CuO + H2 -> (t°) Cu + H2O
0,1 ---> 0,1 ---> 0,1
mFe = 0,3 . 56 = 16,8 (g)
mCu = 64 . 0,1 = 6,4 (g)
b, nH2 = 0,1 + 0,45 = 0,55 (mol)
VH2 = 0,55 . 22,4 = 12,32 (l)
c, PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2
11/30 <--- 1,1 <--- 11/30 <--- 0,55
mAl = 11/30 . 27 = 9,9 (g)
mHCl = 1,1 . 36,5 = 40,15 (g)

\(a,\\ Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\\ Fe_3O_4+4H_2\rightarrow\left(t^o\right)3Fe+4H_2O\)
Loại phản ứng: Phản ứng thế
\(b,n_{Fe}=2.n_{Fe_2O_3}+3.n_{Fe_3O_4}=2.\dfrac{32}{160}+3.0,15=0,85\left(mol\right)\\ m_{Fe}=0,85.56=47,6\left(g\right)\\ c,n_{H_2}=\dfrac{32}{160}.3+4.0,15=1,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=1,2.22,4=28\left(l\right)\)
Em xem sao oxit sắt lại hỏi KL nhôm nha! Vô lí!!!

a) \(m_{CuO}=\dfrac{20.40}{100}=8\left(g\right)\) => \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(m_{Fe_2O_3}=20-8=12\left(g\right)\) => \(n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,1--->0,1------>0,1
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,075--->0,225----->0,15
=> mCu = 0,1.64 = 6,4 (g)
=> mFe = 0,15.56 = 8,4 (g)
b) \(V_{H_2}=\left(0,1+0,225\right).22,4=7,28\left(l\right)\)

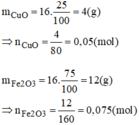
PTHH của phản ứng là:
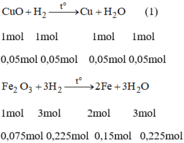
Từ pt (1), ta có: n C u = n C u O = 0,05 mol
m C u = 0,05.64 = 3,2(g)
Từ pt (2), ta có n F e = 2 . n F e 2 O 3 = 2. 0,075 = 0,15 mol
m F e = 0,15.56 = 8,4(g)

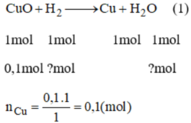
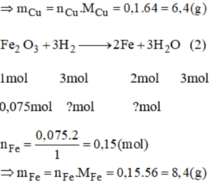
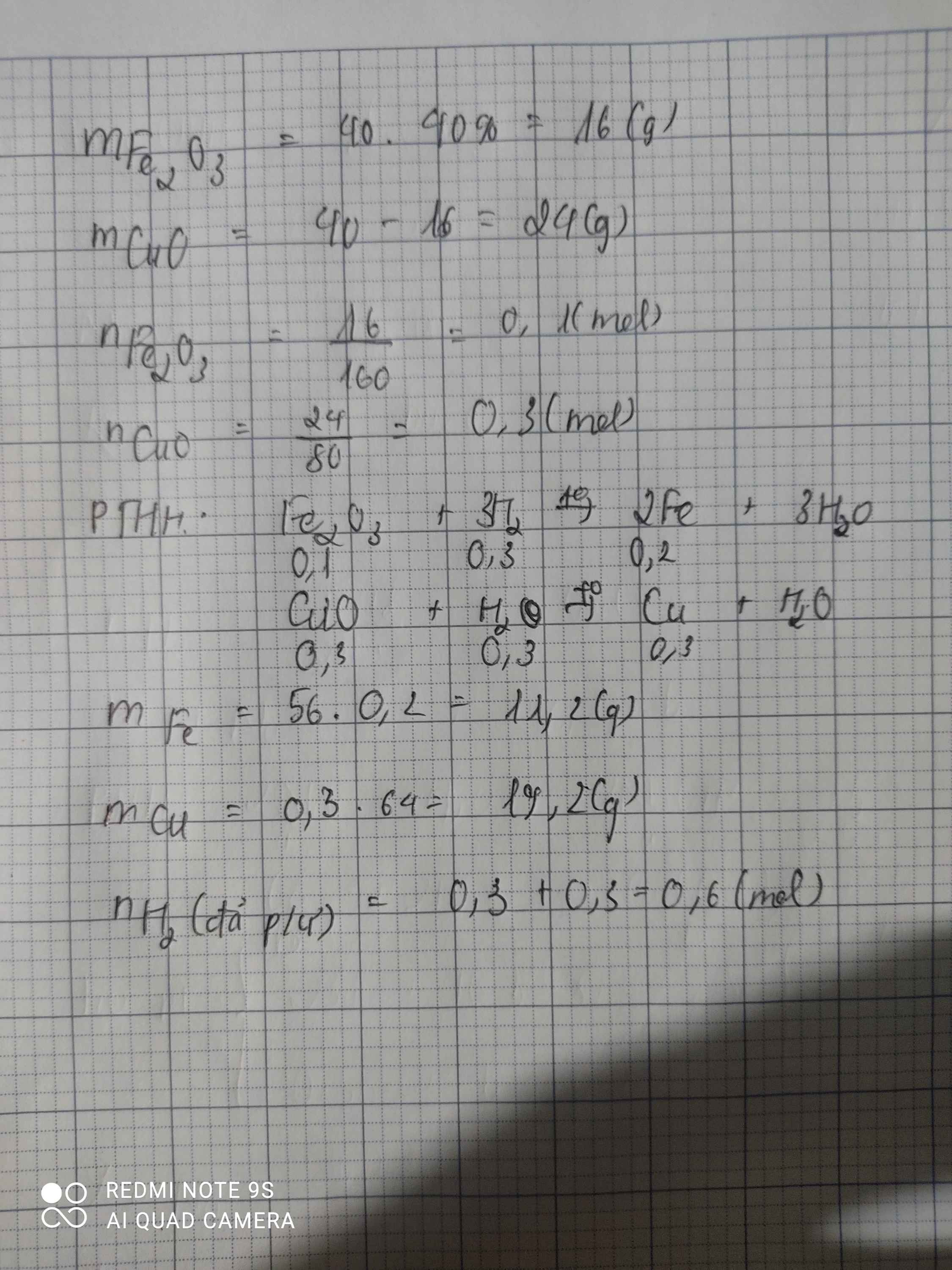
mFe2O3=16 . 75%= 12(g) \(\Rightarrow\) n Fe2O3 = \(\frac{12}{160}\) = 0,075 (mol)
mCuO= 4 (g) \(\Rightarrow\) nCuO = 0,05 (mol)
Fe2O3 + 3H2 \(\underrightarrow{t^o}\) 2Fe + 3H2O
0,075 --> 0,225 -->0,15 (mol)
CuO + H2 \(\underrightarrow{t^o}\) Cu + H2O
0,05 --> 0,05 --> 0,05 (mol)
mFe = 0,15 . 56 = 8,4 (g)
mCu = 0,05 . 64= 3,2 (g)
VH2 = (0,225 + 0,05).22,4 = 6,16 (l)
mấy cái dấu này nghĩ là jv -->