Bài 1: Cho 8,4g sắt tác dụng với 1 lượng dung dịch HCl vừa đủ. Dẫn toàn bộ lượng khí sinh ra qua 16g đồng (II) oxit nóng.
a. Tính thể tích khí hidro sinh ra (đktc)
b. Tính khối lượng kim loại đồng thu đc sau phản ứng.
Bài 2: Khi đốt, than cháy theo sơ đồ sau:
Cacbon + oxi -----> khí cacbon đioxit
a. Viết và cân bằng phương trình
b. Cho biết khối lượng cacbon tác dụng = 9kg, khối lượng oxi tác dụng bằng 24kg. Hãy tính khối lượng khí cacbon dioxit tạo thành
c. Nếu khối lượng cacbon tác dụng = 6kg, khối lượng khí cacbonic thu đc = 22kg, hãy tính khối lượng oxi đã phản ứng
Mọi người giúp em ạ!!!
Thank you all :-*
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+2HCl--->FeCl_2+H_2\left(1\right)\)
\(CuO+H_2\overset{t^o}{--->}Cu+H_2O\left(2\right)\)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15.22,4=3,36\left(lít\right)\)
b. Ta thấy: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\)
Vậy CuO dư.
Theo PT(2): \(n_{Cu}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)

\(n_{HCl}=0.2\cdot1=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(........0.2..............0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.1.......0.1....0.1\)
\(\Rightarrow CuOdư\)
\(m_{Cu}=0.1\cdot64=6.4\left(g\right)\)

a) Zn + 2HCl → ZnCl2 + H2
nZn = 9,75 : 65 = 0,15 mol
Theo ptpư
nH2 = nZn = 0,15 mol
VH2 = 0,15 . 22,4 = 3,36 lit
b) CuO + H2 →H2O + Cu
nCuO = 20 : 80 = 0,25 mol
nCuO p/ư = nH2 = 0,15 mol
=> Dư CuO
nCu thu được= nH2 = 0,15 mol
mCu= 0,15 x 64 = 9,6 gam

a) nFe = \(\dfrac{8,4}{56}=0,15\) mol
Pt: Fe + 2HCl --> FeCl2 + H2
0,15 mol-------------------> 0,15 mol
VH2 sinh ra = 0,15 . 22,4 = 3,36 (lít)
b) nCuO = \(\dfrac{16}{80}=0,2\) mol
Pt: CuO + H2 --to--> Cu + H2O
...............0,15 mol-> 0,15 mol
Xét tỉ lệ mol giữa CuO và H2:
\(\dfrac{0,2}{1}>\dfrac{0,15}{1}\)
Vậy CuO dư
mCu thu được = 0,15 . 64 = 9,6 (g)

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\\ CuO+H_2-^{t^o}\text{ }\rightarrow Cu+H_2O\\ Lậptỉlệ:\dfrac{0,2}{1}>\dfrac{0,1}{1}\\ \Rightarrow CuOdư\\n_{H_2O}=n_{H_2}=0,1\left(mol\right)\\ BTKL:m_{CuO}+m_{H_2}=m_{cr}+m_{H_2O}\\ \Leftrightarrow16+0,1.2=m_{cr}+0,1.18\\ \Rightarrow m_{cr}=14,4\left(g\right)\)

nFe = 16,8/56 = 0,3 (mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
Mol: 0,3 ---> 0,6 ---> 0,3 ---> 0,3
VH2 = 0,3 . 24,79 = 7,437 (l)
mHCl = 0,6 . 36,5 = 21,9 (g)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,3 <--- 0,3 ---> 0,3
mCu = 0,3 . 64 = 19,2 (g)
mFe = 16,8: 56 =0,3(mol)
pthh : Fe + 2HCl --> FeCl2 + H2 (1)
0,3 ->0,6-----------------> 0,3 (mol)
=> VH2 (đkc) = 0,3 . 24,79 ( l)
=> mHCl = 0,6 . 35,5 = 21,9 (g)
pthh : CuO + H2 -t--> Cu+ H2O
0,3<-----0,3 (mol)
=>mCu = 0,3 . 64 = 19,2 (g)
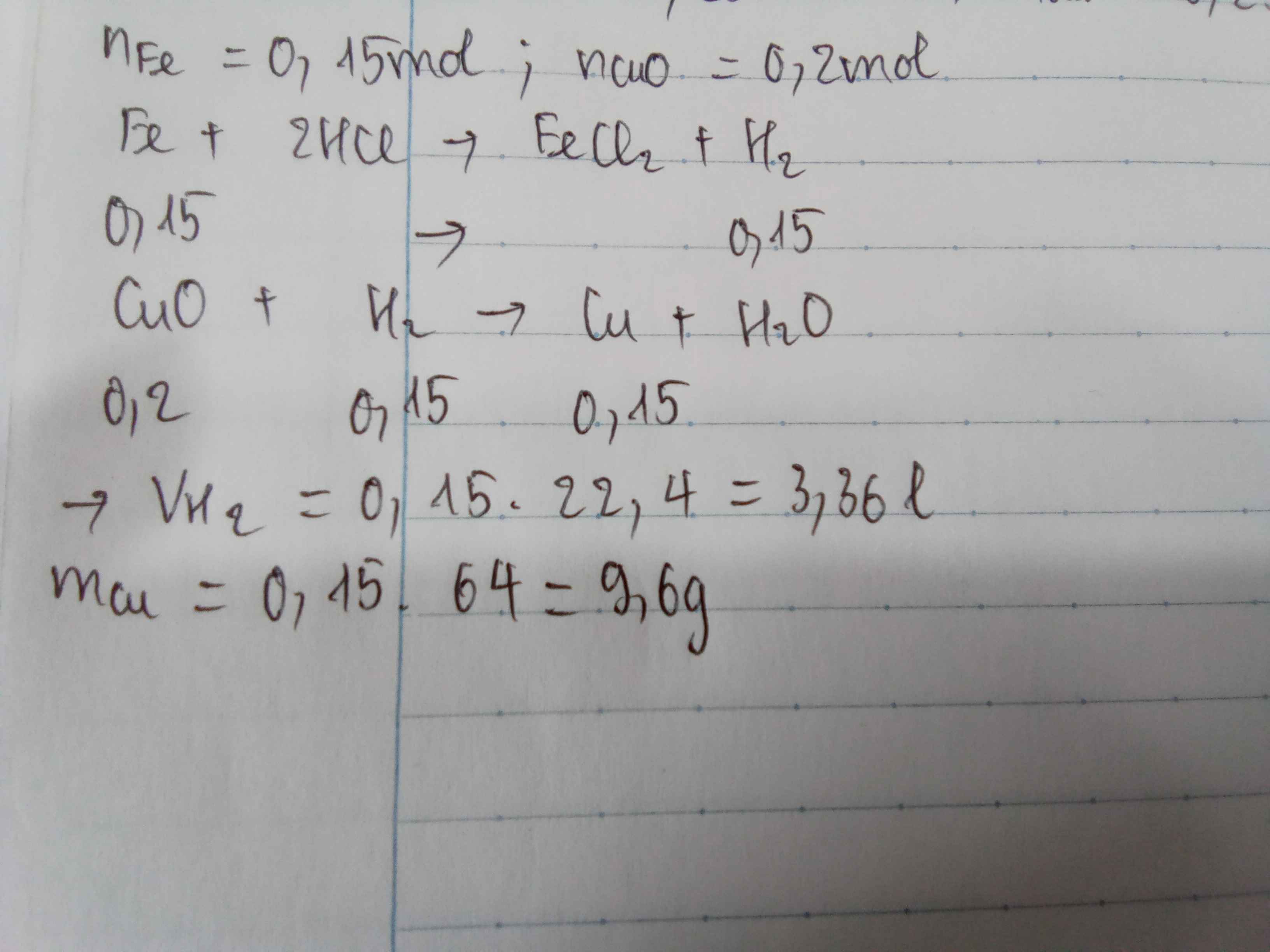


1) \(Fe+2HCl->FeCl_2+H_2\)
\(n_{Fe}=\frac{8,4}{56}=0,15mol\)
\(n_{H_2}=n_{Fe}=0,15mol\)
\(V_{H_2}=0,15.22,4=3,36l\)
-\(CuO+H_2->Cu+H_2O\)
\(n_{CuO}=\frac{16}{80}=0,2mol\)
Vì: \(\frac{0,2}{1}>\frac{0,15}{1}\)=>CuO dư, H2 hết
\(n_{Cu}=n_{H_2}=0,15mol\)
\(m_{Cu}=0,15.64=9,6g\)
2) C+O2->CO2
b) \(n_C=\frac{9}{12}=0,75mol\)
\(n_{O_2}=\frac{24}{32}=0,75mol\)
=> 2 chất phản ứng hết.
\(n_{CO_2}=n_C=0,75mol\)
\(m_{CO_2}=0,75.44=16,8kg\)
b) \(n_C=\frac{6}{12}=0,5mol\)
\(n_{O_2}=n_C=0,5mol\)
\(m_{O_2}=0,5.32=16kg\)