Câu 1 : Đốt cháy hoàn toàn 36 kg than đá chứa 0,5% tạp chất lưu huỳnh , 1,5 % tạp chất không cháy được . Tính thể tích khí CO2 và SO2 tao thành ( đktc )
Câu 2 : Trong phòng thí nghiệm , để điều chế oxi người ta tiến hành phân hủy kali clorat ( KCLO3 ) . Hãy tính hiệu suất phản ứng nếu dem 61,25g kali clorat phân hủy thu được 22,4 lít khí oxi ( đktc )


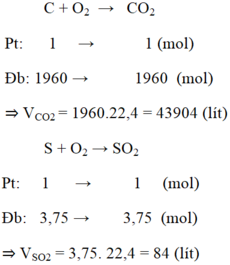
Câu 1:
Phương trình phản ứng cháy của cacbon :
C + O2 -> CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
36. (0,5% + 1,5%) = 0,72kg = 720g.
Khối lượng cacbon nguyên chất là : 36 – 0,72 = 35,28 (kg) = 35280 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
\(V_{CO_2}=\frac{35280}{12}.22,4=65856\left(l\right)\) 43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 -> SO2
Khối lượng tạp chất lưu huỳnh là : 36.0,5% = 0,18 kg = 180 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
\(V_{SO_2}=\frac{180}{32}.22,4=126\left(l\right)\) (lít).
đổi 36 kg = 36000g
ta có pthh C + O2---> Co2
theo pthh 1mol 1 mol 1mol
theo đề 2940 2940 2940 (mol)
mC= 98%*36000/100%=35280g
nC= 35280/12=2940 mol
VCO2=2940*22.4=65856(lit)
Ta có pthh S + O2à SO2
Theo pthh 1mol 1mol 1mol
Theo đề 5.625 5.625 5.625 (mol)
ms= 0.5%36000/100%=180(g)
ns= 180/32=5.625mol
VS02=5.625*22.4=126(lit)