cho 4,48l hỗn hợp X gồm H2 và Cl2 vào bình thủy tinh lớn, sau khi chiếu sáng, ngừng phản ứng được hỗn hợp Y, trong đó 30% HCl về thể tích và thể tích Cl2 giảm xuống còn 20% so với lượng ban đầu.
a, Tính số mol các khí trong hỗn hợp Y
b, cho hỗn hợp Y đi qua 40g dd KOH 14% ở 100*C đc dd Z. Tính nồng độ phần trăm các chất trong dd Z


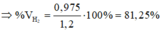

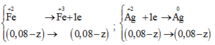
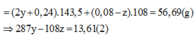
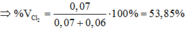
Gọi nH2=a mol nCl2=b mol
nhh khí=0,2 mol=a+b
H2 +Cl2=>2HCl
a mol b mol
0,8b<=0,8b=>1,6b mol
a-0,8b 0,2b mol
nHCl=1,6b=0,3(1,6b+a-0,8b+0,2b)
=>a=0,1625 mol b=0,0375 mol
b)nKOH=0,1 mol
HCl+KOH=>KCl+H2O
0,06 mol =>0,06 mol
3Cl2 +6KOH=>5KCl+KClO3+3H2O
0,05mol<= 0,1 mol
mdd sau=0,2.0,1625.71+0,06.36,5+40=44,4975gam
nKCl=0,06+1/12=43/300mol=>C%ddKCl=23,997%
nKClO3=1/60 mol=>C%ddKClO3=4,588%