Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ thu được khí X. Hấp thụ hết X vào 1 lít dung dịch chứa Ba(OH)2 0,2M và KOH 0,2M thu được dung dịch Y và 32,55 gam kết tủa. Cho dung dịch NaOH vào dung dịch Y lại thấy xuất hiện thêm kết tủa. Viết các phương trình phản ứng xảy ra và tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(4FeS_2+11O_2\rightarrow\left(t^o\right)2Fe_2O_3+8SO_2\) (1)
\(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
\(n_{BaSO_3}=\dfrac{32,55}{217}=0,15\left(mol\right)\)
`@`TH1: Chỉ tạo ra kết tủa
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3\downarrow+H_2O\)
0,15 0,15 ( mol )
Theo ptr (1): \(n_{FeS_2}=\dfrac{n_{SO_2}}{2}=\dfrac{0,15}{2}=0,075\left(mol\right)\)
\(m_{FeS_2}=0,075.120=9\left(g\right)\)
`@` TH2: Ba(OH)2 hết
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3\downarrow+H_2O\)
0,2 ( mol )
0,15 0,15 0,15 ( mol )
\(Ba\left(OH\right)_2+2SO_2\rightarrow Ba\left(HSO_3\right)_2\)
0,05 0,1 ( mol )
Theo ptr (1): \(n_{FeS_2}=\dfrac{n_{SO_2}}{2}=\dfrac{0,15+0,1}{2}=0,125\left(mol\right)\)
\(n_{FeS_2}=0,125.120=15\left(g\right)\)

Đáp án D
4FeS2 +11O2 2Fe2O3 +8SO2
![]()
![]()
Vì cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa nên trong Y có
![]()
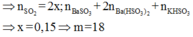
Đáp án D

Đáp án D
X là SO2, nBaSO3 = 21,7/217 = 0,1; nOH- = 0,15.2 + 0,1 = 0,4
SO2 + 2OH- → SO32- + H2O; SO32- + Ba2+ → BaSO3↓
0,1 ← 0,2 ← 0,1 ← 0,1
Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa => Y chứa muối axit
SO2 + OH- → HSO3-
0,2 ← (0,4 – 0,2)
=> nSO2 = 0,1 + 0,2 = 0,3 => nFeS2 = 0,15 => m = 0,15.120 = 18 => Chọn D.

Chọn D
X là SO2, nBaSO3 = 21,7/217 = 0,1; nOH- = 0,15.2 + 0,1 = 0,4
SO2 + 2OH- → SO32- + H2O;
0,1 ← 0,2 ← 0,1 ←
SO32- + Ba2+ → BaSO3↓
0,1
Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa ⇒ Y chứa muối axit
SO2 + OH- → HSO3-
0,2 ← (0,4 – 0,2)
⇒ nSO2 = 0,1 + 0,2 = 0,3 ⇒ nFeS2 = 0,15 ⇒ m = 0,15.120 = 18

Đáp án C.
nBa(OH)2= 0,1.2 = 0,2 (mol); nBaSO3 = 0,1 (mol)
nBaSO3 = 2 nBa(OH)2 - nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
FeS2 → 2SO2 (Bảo toàn S)
0,15 0,3 (mol)
⇒ mFeS2 = 0,15.(56+32.2) = 18 (g)


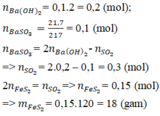

Tính được nBa(OH)2= nKOH= 0,2 mol; nBaSO3= 0,15 mol
Dung dịch Y + NaOH → Kết tủa →chứng tỏ Y có Ba(HSO3)2
Vậy sau phản ứng có các muối BaSO3, Ba(HSO3)2, KHSO3
(Không thể có K2SO3 hoặc kiềm dư vì chúng đối kháng với Ba(HSO3)2)
Các phương trình hóa học:
2FeS2 + 11/2 O2 → Fe2O3+ 4SO2 (1)
SO2+ Ba(OH)2 → BaSO3 + H2O (2)
0,15 0,15 0,15 mol
2SO2 + Ba(OH)2 →Ba(HSO3)2 (3)
0,1 ← (0,2-0,15) mol
SO2+ KOH → KHSO3 (4)
0,2 0,2 mol
Tổng số mol SO2 là 0,15 + 0,1+ 0,2= 0,45mol
Theo PT (1): nFeS2= 0,5. nSO2=0,225 mol → mFeS2= 0,225. 120 = 27 gam
*Tk
Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa
=>Dung dịch Y hình thành đồng thời SO32- và HSO3-
Ta có : nBaSO3 = 0,1 mol < nBa(OH)2 =0,15 mol
=>Kết tủa tính theo SO32- :0,1 mol
SO2 + 2OH- → SO32- + H2O
0,1......0,2......0,1
SO2 + OH- → HSO3-
0,2........(0,4-0,2)
=> nSO2 = 0,3 mol
Bảo toàn nguyên tố S: \(n_{SO_2}=n_{FeS_2}.2\)
=> nFeS2 = 0,15 mol
=> m = 18 gam.