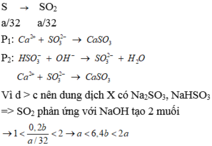Cho a(g) NaOh vào 400ml dd Nahco3 được dung dịch A , chia a thành 3 phần bằng nhau : -phần 1 : Tác dụng với bacl2 dư thu được 49,25g kết tủa,Phần 2 : Cho Ca(oh)2 vào thấy xuất hiện 30g kết tủa.Tính a? ,CmNaoh ,Phần 3: Cho từ từ từng giọt vào HCl 320ml 1M , có bao nhiêu khí thoát ra?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$n_{SO_2} = n_S = \dfrac{a}{32}(mol)$
$n_{NaOH} = 0,2b(mol)$
Ta thấy : d > c
Chứng tỏ X gồm hai muối $Na_2SO_3$ và $NaHSO_3$
Suy ra :
$1 < n_{NaOH} : n_{SO_2} < 2$
$⇔ 1< 0,2b : \dfrac{a}{32} < 2$
$⇔ \dfrac{a}{32} < 0,2b < \dfrac{a}{16}$
$⇔ \dfrac{5a}{32} < b < \dfrac{5a}{16}$

Đáp án : D
Cho dung dịch BaCl2 dư vào dung dịch A thấy có xuất hiện kết tủa , chứng tỏ trong dung dịch A có muối Na2CO3
Vậy ta xét trường hợp 1 : CO2 phản ứng với NaOH chỉ taoh muối Na2CO3và NaOH dư
Phần 1 :
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
a/ 197 a/197
Phần 2: Ba(OH)2 + Na2CO3 → BaCO3 + 2 NaOH
b/197 b/197
ta thấy: n Na2CO3(phần 1) = a/197 ≠ n Na2CO3(phần 2) = b/197
=> Trường hợp này loại
Vậy trường hợp 2 : CO2 tác dụng với dung dịch NaOH tạo cả 2 muối Na2CO3 và NaHCO3đúng

Đáp án D
Do dung dịch A tác dụng với BaCl2 dư thu được kết tủa → A chứa muối Na2CO3
Do dung dịch A tác dụng với dung dịch Ba(OH)2 dư thu được kết tủa nhiều hơn khi tác dụng với dung dịch BaCl2 dư nên A ngoài Na2CO3 còn chứa NaHCO3
CO2+ NaOH → NaHCO3
CO2+ 2NaOH → Na2CO3+ H2O
BaCl2+ Na2CO3→ BaCO3 + 2NaCl
Ba(OH)2+ Na2CO3 → BaCO3+ 2NaOH
Ba(OH)2+ 2NaHCO3 → BaCO3 ↓ + Na2CO3+ 2H2O

Gọi số mol của NaHCO3 và Na2CO3 trong 2 phần lần lượt là x và y (mol)
Phần I :
2NaHCO3 + Ba(OH)2 --> BaCO3↓ + Na2CO3 + H2O
Na2CO3 + Ba(OH)2 --> BaCO3↓ + NaOH
=> nBaCO3 = 1/2nNaHCO3 + nNa2CO3 = (x/2 + y) mol
=> m1 = (x/2 + y).197 gam
Phần II :
Na2CO3 + BaCl2 --> BaCO3↓ + 2NaCl
=> nBaCO3 = y mol <=> m2 = 197y gam
mà \(\dfrac{m_1}{m_2}=1.25\) => \(\dfrac{\text{(x/2 + y).197}}{197y}\)=1,25
Rút gọn phương trình => y = 2x
Vậy hỗn hợp A gồm NaHCO3 và Na2CO3 với nNa2CO3 = 2nNaHCO3
=> mA = 84x + 106.2x = 296x gam
%mNaHCO3 = \(\dfrac{84x}{296x}.100\)= 28,37% và %mNa2CO3 = 100-28,37 =71,63%

- Phần 1:
PT: \(Na_2CO_3+BaCl_2\rightarrow2NaCl+BaCO_{3\downarrow}\)
Ta có: \(n_{BaCO_3}=\dfrac{19,7}{197}=0,1\left(mol\right)\)
Theo PT: \(n_{Na_2CO_3}=n_{BaCO_3}=0,1\left(mol\right)\)
- Phần 2:
Ta có: \(n_{CaCO_3}=\dfrac{30}{100}=0,3\left(mol\right)\)
PT: \(KHCO_3+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+KOH+H_2O\)
\(Na_2CO_3+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+2NaOH\)
Theo PT: \(n_{CaCO_3}=n_{KHCO_3}+n_{Na_2CO_3}\)
\(\Rightarrow0,3=n_{KHCO_3}+0,1\Rightarrow n_{KHCO_3}=0,2\left(mol\right)\)
⇒ X gồm: 0,4 (mol) KHCO3 và 0,2 (mol) Na2CO3
⇒ m = 0,4.100 + 0,2.106 = 61,2 (g)
Bạn xem lại đề nhé, cả KHCO3 và NaHCO3 đều không có pư với BaCl2 đâu.