Trả lời gấp giùm em nhá, em cảm ơn trước...........
Cho 4,07 gam hỗn hợp Zn và Na2CO3 tác dụng hết với dung dịch HCl 25% Khi phản ứng xong thu được dung dịch X và hỗn hợp khí Y có tỉ khối so với O2 bằng 0,5875 .
a. Tính % khối lượng mỗi chất trong hỗn hợp đầu.
b. Tính nồng độ phần trăm của axit có trong dung dịch X. Biết dùng dư axit 20% theo khối lượng


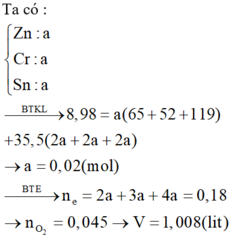
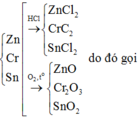
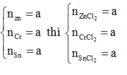




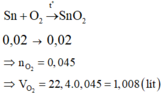
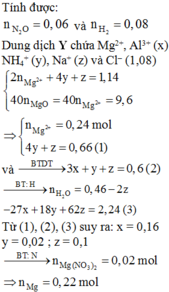
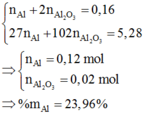

Zn + 2HCl => ZnCl2 + H2
Na2CO3 + 2HCl=> 2NaCl + H2O + CO2
MY = 0,5875.32 = 18,8
áp dụng sơ đồ đường chéo ta đc nH2 : nCO2 = 3:2
mà nH2 = nZn ; nCO2 = nNa2CO3
=> nZn = 3/2 nCO2
ta có \(65.\frac{3}{2}x+106x=4,07\left(g\right)\) => x= 0,02 mol => nZn =0,03
a. => % na2CO3 = \(\frac{0,02.106}{4,07}.100\%=52,088\%\)
=> % Zn = 47,912%
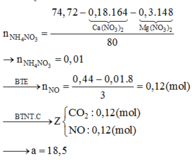
b. nHCl pư = 2 .nZn + 2. nNa2CO3 = 2.0,03+ 2.0,02 = 0,1
=> mHCl pư = 0,1.36,5 = 3,65 (g)
=> m HCl dùng = 3,65.120% = 4,38 (g)
=> mdd HCl = \(\frac{4,38.100}{25}=17,52\)
=> mdd = 4,07 + 17,52 - 0,03.2-0,02.44 = 20,65(g)
mHCl dư = 4,38 - 3,65 = 0,73(g)
C% HCl dư = \(\frac{0,73}{20,65}.100\%\) = 3,535%