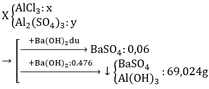
Cho hh gồm AlCl3 và Al(SO4)3 vào H2O tạo thành 200g dd X
Chia hh X thành 2 phần không bằng nhau:
P1:tác dụng với BaCl2 dư→13,98g kết tủa trắng
P2:tác dụng với 476 ml dd Ba(OH)2 1M.Sau pư thu được 69,024g kết tủa
Biết m P2=n*m P1 và lượng chất tan trong phần 2 nhiều hơn phần 1 là 32.535g




Mấy ctv đâu :)