Tính nồng độ mol của 8g NaOH có trong 200ml nước. Tính khối lượng của H2SO4 10%(D=1.14G/ML)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1)
a,\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(C_{M_{ddNaOH}}=\dfrac{0,2}{0,242}=0,83M\)
\(C\%_{ddNaOH}=\dfrac{8.100\%}{242}=3,3\%\)
b,\(n_{H_2SO_4}=0,1.0,15=0,015\left(mol\right)\)
PTHH: 2NaOH + H2SO4 → Na2SO4 + 2H2O
Mol: 0,03 0,015
\(C_{M_{ddNaOH}}=\dfrac{0,03}{0,2}=0,15M\)

a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)

a)
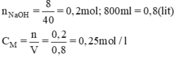
b) nNaOH có trong 200ml dung dịch NaOH 0,25M là

VH2O cần dùng để pha loãng 200ml dung dịch NaOH 0,25M để dung dịch NaOH 0,1M.
VH2O = 500 - 200 = 300ml H2O.

a, \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Ta có: 40nNaOH + 56nKOH = 25,44 (1)
\(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}+\dfrac{1}{2}n_{KOH}=0,3.0,9=0,27\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{NaOH}=0,3\left(mol\right)\\n_{KOH}=0,24\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,3.40=12\left(g\right)\\m_{KOH}=0,24.56=13,44\left(g\right)\end{matrix}\right.\)
b, \(m_{ddH_2SO_4}=300.1,14=342\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,27.98}{342}.100\%\approx7,74\%\)

a) mNaOH= 200.10%=20(g)
b) nNaOH=0,4(mol)
=>CMddNaOH=0,4/0,2=2(M)

\(n_{NaOH}=0,2.1=0,2\left(mol\right)\\ n_{H_2SO_4}=0,3.1,5=0,45\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2------->0,1--------->0,1
Xét \(\dfrac{0,2}{2}< \dfrac{0,45}{1}\Rightarrow\) \(H_2SO_4\)dư
Trong dung dịch D có:
\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,45-0,1=0,35\left(mol\right)\\n_{Na_2SO_4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{H_2SO_4}=\dfrac{0,35}{0,5}=0,7M\\CM_{Na_2SO_4}=\dfrac{0,1}{0,5}=0,2M\end{matrix}\right.\)
b
\(Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\)
0,35<---------0,35
\(V_{Ca\left(OH\right)_2}=\dfrac{0,35.74}{1,2}=\dfrac{259}{12}\approx21,58\left(ml\right)\\ \Rightarrow V_{dd.Ca\left(OH\right)_2}=\dfrac{\dfrac{259}{12}.100\%}{10\%}=\dfrac{1295}{6}\approx215,83\left(ml\right)\)
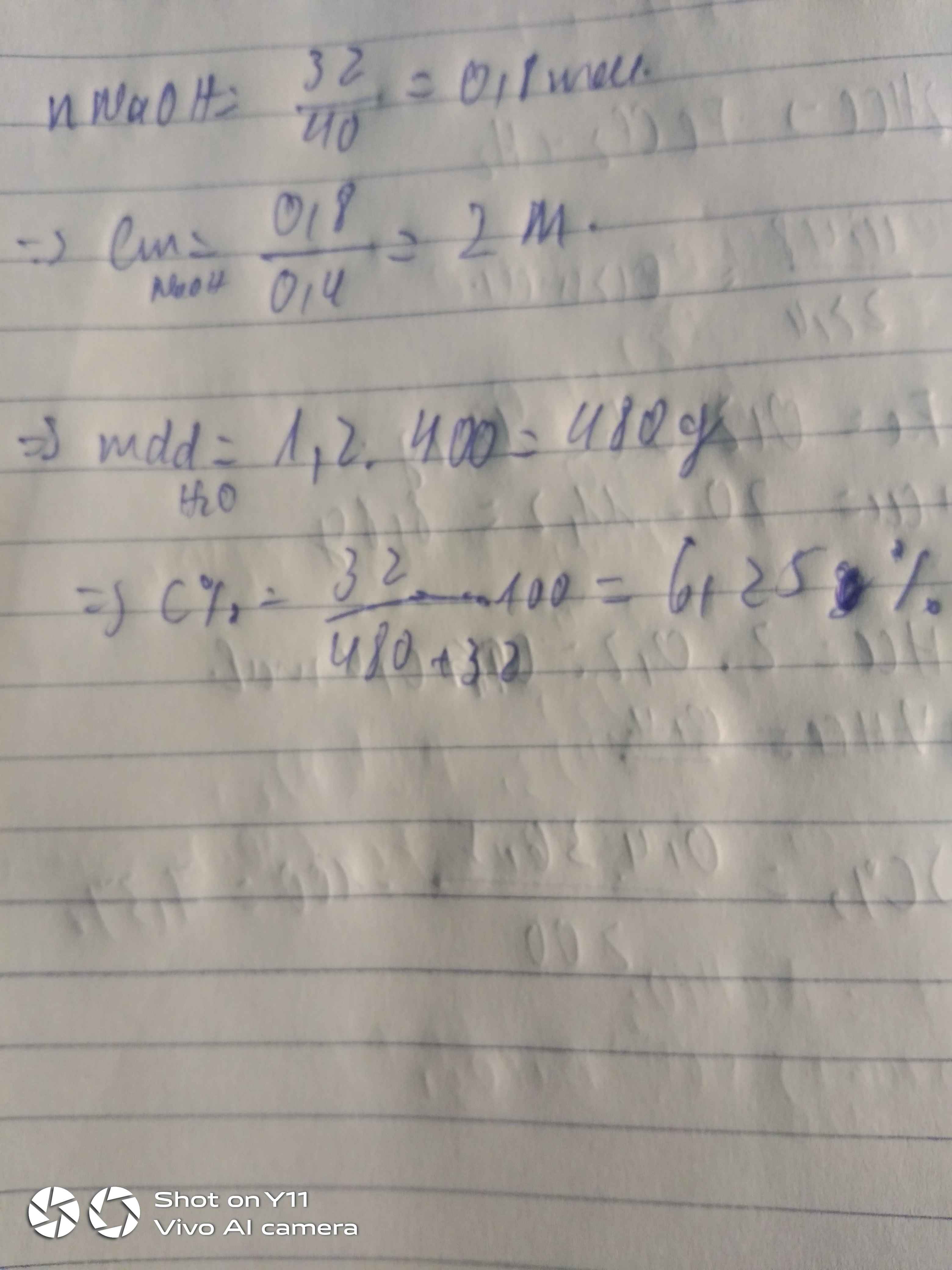
1) \(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
200ml=0,2(l)
\(C_M=\dfrac{n_{ct}}{V_{dd}}=\dfrac{0,2}{0,2}=1\left(M\right)\)