Để m gam bột sắt (A) ngoài không khí, sau 1 thời gian biến thành hỗn hợp B có khối lượng 12 g gồm Fe,FeO,Fe3O4, Fe2O3. Cho B tác dụng hoàn toàn với dung dịch HNO3 thấy sinh ra 2.24 lít khí NO duy nhất. Tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cách này ko cần viết phương trình :3
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=30\) (1)
Ta có: \(n_{NO}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+3n_{NO}\) \(\Rightarrow3a-2b=0,75\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,45\\b=0,3\end{matrix}\right.\)
Vì mFe trong oxit cũng là mFe ban đầu \(\Rightarrow m_{Fe}=0,45\cdot56=25,2\left(g\right)\)

Quy đổi hỗn hợp thành : Fe ( x mol ) , O ( y mol )
\(m=56x+16y=12\left(g\right)\left(1\right)\)
Bảo toàn e :
\(3x=0.1\cdot3+2y\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\cdot\left(g\right)\)
\(m_{Fe\left(NO_3\right)_3}=0.18\cdot242=43.56\left(g\right)\)

Coi : B gồm : Fe ( x mol) , O ( y mol)
\(m_B=56x+16y=12\left(h\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
Bảo toàn e :
\(3x=2y+0.15\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\left(g\right)\)
Quy đổi hỗn hợp về Fe và O.
Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_O=y\left(mol\right)\end{matrix}\right.\)
⇒ 56x + 16y = 12 (1)
Ta có: \(n_{SO_2}=0,15\left(mol\right)\)
Theo ĐLBT mol e, có: 3x - 2y = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,18\left(mol\right)\\y=0,12\left(mol\right)\end{matrix}\right.\)
⇒ mFe = 0,18.56 = 10,08 (g)
Bạn tham khảo nhé!

Đáp án B
Xét giai đoạn A tác dụng với H2SO4 đặc, nóng, dư:
Số mol SO2 thu được là: n SO 2 = 0 , 15 mol
Qui đổi hỗn hợp A thành Fe : a mol; O : b mol
![]()
Sơ đồ phản ứng :
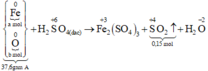
Các quá trình nhường, nhận electron:
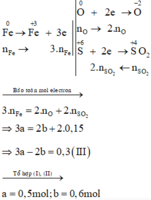
Xét giai đoạn để m gam Fe ngoài không khí:
Sơ đồ phản ứng :


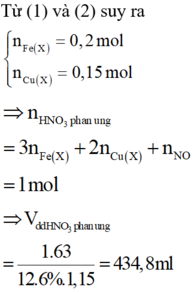
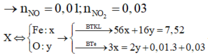
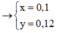
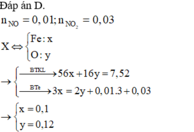
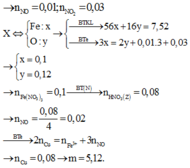
2Fe +O2 --> 2FeO(1)
4Fe +3O2 -->2Fe2O3 (2)
3Fe + 2O2 -->Fe3O4 (3)
Fe +4HNO3 --'> Fe(NO3)3 +NO +2H2O(4)
3FeO +10HNO3 --> 3Fe(NO3)3 +NO +5H2O (5)
3Fe3O4 +28HNO3 --> 3Fe(NO3)3 +NO +14H2O(6)
giả sử nFe= a(mol)
nFeO=b(mol)
nFe2O3=c(mol)
nFe3O4=d(mol)
=> 56a+72b+160c+232d =12 (I)
theo (4) :nNO=nFe=a(mol)
theo(5) : nNO=1/3 nFeO=1/3c(mol)
theo (6) : nNO=1/3 nFe3O4=1/3d(mol)
=> a+1/3c+1/3d=2,24/22,4=0,1(II)
nhân (II) với 56 rồi lấy (I) trừ (II) ta có :
\(\dfrac{56a+72b+160c+232d}{56a+\dfrac{56}{3}c+\dfrac{56}{3}d}=\dfrac{160}{3}b+160c+\dfrac{640}{3}d\)
\(\Leftrightarrow\)b+3c+4d=0,12
ta có :
nO(trong FeO)=nFeO=b(mol)
nO(trongFe2O3)=3nFe2O3=3c(mol)
nO(trong Fe3O4)=4nFe3O4=4d(mol)
=> mFe(ban đầu)= \(12-16\left(b+3c+4d\right)\)
= \(12-16.0,12=10,08\left(g\right)\)