Cho 3.2 g oxit kim loại có hóa trị n băng 200 ml dung dịch axit H2SO4 loãng . Khi thêm vào hỗn hợp sau phản ứng một lượng CaCO3 vừa đủ còn thấy thoát ra 0.224 lít khí CO2 ở đktc . Sau đó cô cạn dd thu đc 9.36 g muối sunfat khô .
a) tìm công thức của oxit
b) tính nồng độ mol của dd H2SO4 đã dùng .

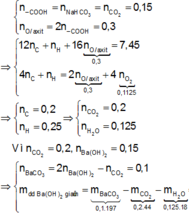
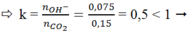
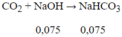
gọi CTHH kim loại đó là M
=>CTHH của oxit kim loại M2On (n thuộc N*)
M2On+ nH2SO4 loãng =>M2(SO4)n +nH2O (1)
do khi cho CaCO3 vào hỗn hợp sau phản ứng mà có khí CO2 thoát ra nên lượng axit trong phản ứng ban đầu còn dư. và lượng muối sunfat sau khi cô cạn là gồm M2(SO4)n và CaSO4
CaCO3+H2SO4=>CaSO4+H2O+CO2 (2)
theo bài ra:
n CO2 = 0,224/22,4 = 0,01 mol
theo (2): nCaSO4 = n CO2 = 0,01 mol
=> m CaSO4 = 0,01*136 = 1,36 gam
=> m M2(SO4)n = 9,36-1,36 = 8 gam
theo bài ra :
gọi số n M2On là x mol (x>0)
=> n M2(SO4)n = x mol
m M2On = (M*2+16*n)*x = 3,2
m M2(SO4)n = (M*2+96*n)*x = 8
trừ hai vế cho nhau sẽ ra: 112*n*x = 4,8
giả sử n = 1 => x ~ 0,04 => M~32 (loại)
giả sử n = 2 => x ~ 0,02 => M~64(Cu)
tiếp tục giả sử đến n=4 thì vẫn chỉ có mỗi n=2 là phù hợp
=> kim loại M là Cu
=> CT của oxit là CuO
b) viêt lại phương trình:
CuO+H2SO4 => CuSO4+H2O (1)
n H2SO4 (1) = n CuO = 3,2/80 = 0,04 mol
n H2SO4 (2) = n CO2 = 0,01 mol
=> nồng độ mol của dd H2SO4 là:
(0,01+0,04)/0,02 = 2,5 M