cho M(g) hỗn hơp gồm Fe,Fe2O3 tác dụng với 200ml dd HNO3 3,2 M phản ứng xong thu dược 2,24l khí NO và còn lại 1,46g kim loại.Tính M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp ban đầu thành Fe và O
Vì sau phản ứng còn dư kim loại => Fe chỉ bị oxi hóa lên Fe2+
Fe --> Fe2+ +2e
x...................2x
O + 2e -> O2-
y........2y
N+5 + 3e -> N+2
0,3.......0,1
Gọi x là nFe, y là nO
Ta có: 56x + 16y = 18,5 - 1,46
2x = 2y + 0,3
Giải ra: x= 0,27 mol, y = 0,12 mol
=> Khối lượng muối trong Y = 0,27 . 180 = 48,6 g
=> nHNO3 = nNO3- (trong muối) + nNO = 0,27.2 + 0,1 = 0,64 mol
=> C(HNO3) = 0,64/0,2 = 3,2 M

Khối lượng Fe dư là 1,46g, do đó khối lượng Fe và Fe3O4 đã phản ứng là 17,04g. Vì sau phản ứng sắt còn dư nên trong dung dịch D chỉ chứa muối sắt (II).
Sơ đồ phản ứng:
Fe, Fe3O4 + HNO3 → Fe(NO3)2 + NO + H2O
Mol: 2n+0,1 n 0,1 0,5( 2n+0,1)
Đặt số mol của Fe(NO3)2 là n, áp dụng định luật bảo toàn nguyên tố đối với nitơ ta có số mol của axit HNO3 là 2n+ 0,1. Số mol H2O bằng một nửa số mol của HNO3.
Áp dụng định luật bảo toàn khối lượng ta có:
17,04 + 63(2n + 0,1) = 242n + 0,1.30 + 18.0,5(2n + 0,1)
giải ra ta có n = 2,7, suy ra [ HNO3 ] = (2.2,7 + 0,1): 0,2 = 3,2M
Đáp án A

Quy đổi hỗn hợp ban đầu thành Fe và O
Vì sau phản ứng còn dư kim loại => Fe chỉ bị oxi hóa lên Fe2+
Fe --> Fe2+ +2e
x...................2x
O + 2e -> O2-
y........2y
N+5 + 3e -> N+2
0,3.......0,1
Gọi x là nFe, y là nO
Ta có: 56x + 16y = 18,5 - 1,46
2x = 2y + 0,3
Giải ra: x= 0,27 mol, y = 0,12 mol
=> Khối lượng muối trong Y = 0,27 . 180 = 48,6 g
=> nHNO3 = nNO3- (trong muối) + nNO = 0,27.2 + 0,1 = 0,64 mol
=> C(HNO3) = 0,64/0,2 = 3,2 M
\(n_{NO}=\dfrac{2,24}{22,4}=0,1mol\)
3Fe3O4+28HNO3\(\rightarrow\)9Fe(NO3)3+NO+14H2O
x..........\(\rightarrow\dfrac{28x}{3}\)......\(\rightarrow\)3x........\(\rightarrow\)\(\dfrac{x}{3}\)mol
Fe+4HNO3\(\rightarrow\)Fe(NO3)3+NO+2H2O
y...\(\rightarrow\)4y........\(\rightarrow\)y.........\(\rightarrow\)y
Fe+2Fe(NO3)3\(\rightarrow\)3Fe(NO3)2
\(\dfrac{3x+y}{2}\)\(\leftarrow\)3x+y\(\rightarrow\)\(\dfrac{9x+3y}{2}\)
-Sau phản ứng còn lại 1,46 g Fe\(\rightarrow\)mX(pu)=18,5-1,46=17,04g
-Ta có hệ phương trình:
\(\left\{{}\begin{matrix}232x+56\left(y+\dfrac{3x+y}{2}\right)=17,04\\\dfrac{x}{3}+y=0,1\end{matrix}\right.\)
\(\Leftrightarrow\)\(\left\{{}\begin{matrix}316x+84y=17,04\\x+3y=0,3\end{matrix}\right.\)\(\Leftrightarrow\)\(\left\{{}\begin{matrix}x=0,03\\y=0,09\end{matrix}\right.\)
-Muối trong Y chỉ có Fe(NO3)2:\(\dfrac{9x+3y}{2}=\dfrac{9.0,03+3.0,09}{2}=0,27mol\)
\(m_{Fe\left(NO_3\right)_2}=0,27.180=46,8gam\)
\(n_{HNO_3}=\dfrac{28x}{3}+4y=\dfrac{28.0,03}{3}+4.0,09=0,64mol\)
\(C_{M_{HNO_3}}=\dfrac{n}{v}=\dfrac{0,64}{0,2}=3,2M\)

Đáp án A
Do Fe dư nên chỉ tạo ra Fe2+.
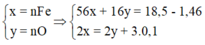
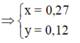
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O + 2e → H2O
=> nHNO3 = nH+ = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64
=> [HNO3] = 0,64/0,2 = 3,2M => Chọn A.

a,\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{HCl}=0,5.0,4=0,2\left(mol\right)\)
PTHH: 2K + 2H2O ---> 2KOH + H2 (Fe và Cu ko tan trong nước)
0,2 0,1
Fe + 2HCl ---> FeCl2 + H2 (Cu ko phản ứng với HCl)
0,1 0,2
mChất rắn còn lại = mCu = 6,6 (g)
\(\rightarrow\left\{{}\begin{matrix}m_K=39.0,2=7,8\left(g\right)\\m_{Fe}=56.0,1=5,6\left(g\right)\\m_{Cu}=6,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow m_{\text{hhkimloại}}=7,8+5,6+6,6=20\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_K=\dfrac{7,8}{20}=39\%\\\%m_{Fe}=\dfrac{5,6}{20}=28\%\\\%m_{Cu}=100\%-39\%-28\%=33\%\end{matrix}\right.\)
b, PTHH: FexOy + yH2 --to--> xFe + yH2O
\(n_{O\left(\text{trong oxit}\right)}=n_{H_2O}=n_{H_2}=0,1\left(mol\right)\\ \rightarrow n_{Fe\left(\text{trong oxit}\right)}=\dfrac{5,8-0,1.16}{56}=0,075\left(mol\right)\)
\(\rightarrow x:y=n_{Fe}:n_O=0,075:0,1=3:4\)
CTHH của oxit sắt Fe3O4
Sửa đề thành 2,24 l khí C nhé :)
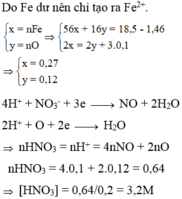

do còn kim loại không tan nên Fe--> Fe2+
Quy hh oxit về Fe và O
Ta có:
Fe--> Fe2+ +2e
x------------>2x
O+2e-->O2-
N+5 +3e--> N+2
2x=(m-1,46-56x)/8 +0,1.3 <=> 9x=m/8+0,1775
Mặt khác theo bảo toàn điện tích thì 2x=nNO3-(dd sau pu)=nHNO3-nNO=0,64-0,1=0,54
=> m=18,02 gam
mình không chắc là bạn đúng hay sai nhưng khác với kết quả của cô giáo