cần lấy bao nhiêu lít khí hidro và nito để điều chế được 67,2 lít khí amoniac ? Biết rằng thể tích của các khí đều được đo trong cùng một điều kiện nhiệt độ , áp suất hiệu suất của phản ứng là 25%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi hiệu suất đạt 25% thì được 67.2 lít
Theo lí thuyết sẽ là 100% hay khi đó =67,2 x 4=268.8 lit =12mol
N2 +3H2 =>2NH3
6<.......18<.......12
vN2 =6 x 22,4 =134.4lit
vH2 =1 x 22,4=403,2LIT

Chọn D
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ về thể tích cũng là tỉ lệ về số mol.
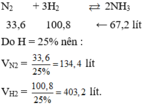

Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
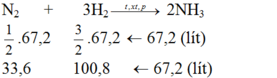
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
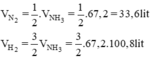
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
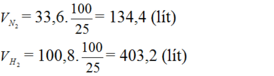

Số mol của NH3 là: nNH3(thực tế)= 17/17=1 (mol)
---> nN2 =1/2 nNH3 = 0.5 mol, nH2=3/2 nNH3=1.5 mol
Do thực tế NH3 sinh ra chỉ bằng 25% lượng NH3 có thể sinh ra. Vậy ta có:
nNH3 (100%) được sinh ra=nNH3(thực tế)*4=1*4=4mol
--> nN2( thực)= 0.5*4=2mol--> V N2 = 44,8 lít
nH2 (thực)=1,5*4 mol=6mol ---> VH2 = 134,4 lít
có pt: N2 + 3H2 = 2NH3
theo đề bài thì nNH3 =17/17=1 mol
suy ra từ phương trình thì nN2=1/2nNH3 *100/25=2 mol
vậy V N2=2*22,4=44,8 lit
va nH2=3/2 nNH3* 100/25 =6 mol
vậy V H2 =6*22,4= 134,4 lit

. 44,8 lít N2 và 134,4 lít H2
Do hiệu suất 25 % nên thể tích N2, H2 cần gấp 4 lần so với lí thuyết.
N2 + 3H2 => 2NH3
33,6 100,8 <= 67,2
mà H= 25%
=> VN2 = 134,4
VH2= 403,2