Oxit cao nhất của một nguyên tố là RO3, trong hợp chất của nó với hiđro có 5,88% H về khối lượng. Xác định nguyên tử khối của nguyên tố đó.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nguyên tố 'R' có oxit cao nhất là R2O3, => Hóa trị cao nhất của 'R' là 6
Hóa trị thấp nhất của R trong hợp chất với oxygen + Hóa trị của R trong hợp chất
thi với hydrogen = 8
=> Hóa trị của R trong hợp chất thi với hydrogen = 8 - 6 = 2
=> Công thức hợp chất thi với hydrogen là RH2
Ta có: %MH(R+H2) = (2/(R+2)) * 100
=> 5,88 = (2/(R+2)) * 100
=> R = 32
=> R là Sulfur (S)

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hidro của nó là RH2, trong phân tử RH2, có 5,88%H về khối lượng nên R có 100% - 5,88% = 94,12% về khối lượng.
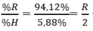
⇒ R = 32 ⇒ R là S. Công thức phân tử là SO3 và H2S.

Đáp án B
Hướng dẫn Oxit cao nhất là RO3 → R thuộc nhóm VIA
Hợp chất với hidro có dạng RH2
![]()
Đó là nguyên tố lưu huỳnh (S)

oxit cao nhất với nguyên tố R là RO3 => hợp chất với hidro là RH2
ta có : 200/(R + 2) = 5,88 => R = 32 (lưu huỳnh)

Đáp án A
Vì công thức oxit cao nhất của Y là YO3
Nên công thức hợp chất khí của Y với hidro là YH2.
Khi đó phần trăm khối lượng của H trong YH2 là:
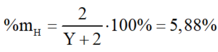 Y = 32 là S
Y = 32 là S
Do đó vị trí của Y trong bảng tuần hoàn là chu kì 3, nhóm VIA

Đáp án B
Vì oxit cao nhất của R là RO3
Nên công thức hợp chất khí với hidro của R là RH2.
Khi đó phần trăm khối lượng của hidro trong RH2 là:
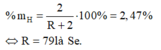

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.