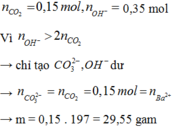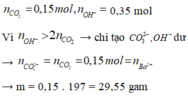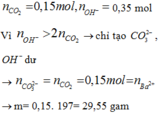Tính khoảng khối lượng kết tủa thu được khi hấp thụ hoàn toàn a mol CO2 vào dung dịch có 0,3 mol Ca(OH)2 biết 0,15 mol ≤ a ≤ 0,25 mol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì lượng CO2 thay đổi mà lượng kết tủa vẫn giữ nguyên nên:
Khi sục a mol CO2 thì Ca(OH)2 dư, khi sục 1,5 mol CO2 thì CaCO3 bị hoà tan một phần
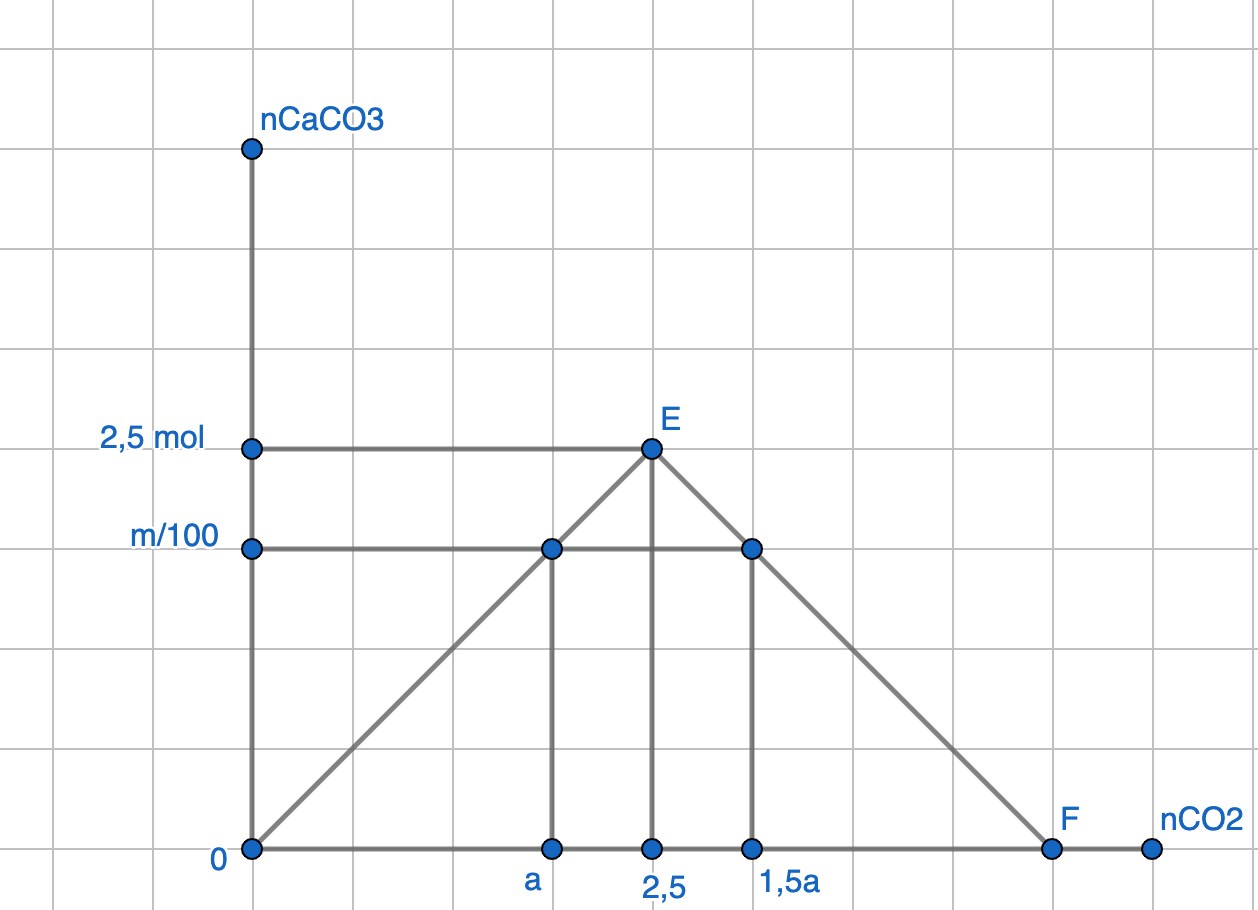
từ đồ thị suy ra: a = 2,5 .2 / 2,5 = 2 (mol)
=> m = 200g

Đáp án : D
Ta thấy : 1 < nOH- / nCO2 = 0,5/0,3 = 1,67 < 2
=> tạo 2 muối CaCO3 và Ca(HCO3)2
2CO2 + Ca(OH)2 → Ca(HCO3)2
2y y y
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
x x x
Ta có :
x + y = 0,25 (1)
x + 2y = 0,3 (2)
giải (1) và (2) ta được : x = 0,2 ; y= 0,05
=> ta thấy : m CaCO3 = 0,2.100 = 20g > m CO2 = 0,3.44 = 13,2g
=> khối lượng dung dịch giảm 20 – 13,2 = 6,8 gam

nCO2 = 0,15 mol
nOH = 0,15 +0,1.2 =0,35
→ phản ứng tạo CO32- : 0,15 mol ( Bảo toàn C )
CO32- + Ba2+ → BaCO3 → có 0,1 mol BaCO3
→mkết tủa = 19,7

TH1: Hấp thụ hết hoặc Ca(OH)2 dư
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\\ 0,2......0,2......0,2\left(mol\right)\)
=>b=0,2(mol)
TH2: CO2 dư
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\\ Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
Với:
\(n_{CO_2}=0,6\left(mol\right)\\ n_{CaCO_3}=b=0,2\left(mol\right)\\ \rightarrow n_{Ca\left(OH\right)_2}=0,2+\dfrac{0,6-0,2}{2}=0,4\left(mol\right)\)
=>a=0,4(mol)
Vây: \(\left\{{}\begin{matrix}a=0,4\\b=0,2\end{matrix}\right.\)
Khi cho 0,2 mol CO2 hay 0,6 mol Co2 vào a mol Ca(OH)2 đề thu kết tủa
=> 0,2 mol Co2 vào a mol Ca(OH)2 chỉ tạo muối CaCO3
0,6 mol Co2 vào a mol Ca(OH)2 tạo cả hai muối CaCO3 và Ca(HCO3)2
PTHH của 0,2 mol CO2
CO2 + Ca(OH)2 ===> CaCO3 + H2O
0,2 --------------------------0,2
theo pthh: n CaCO3 = 0,2 ( mol ) => b = 20 ( g )
PTHH của 0,6 mol CO2
Co2 + Ca(OH)2 ====> CaCO3 + H2O
a---------a--------------------a
Co2 + CaCO3 + H2O =====> Ca(HCO3)2
( 0,6 - a )-------(0,6 - a )
theo pthh: n CaCO3 dư = a - 0,6 + a =2a - 0,6
=> 2a - 0,6 = 0,2 => a = 0,4 ( mol )