Khối lượng riêng của Fe là 7,8g/cm^3. Tìm bán kính nguyên tử Fe biết trong tinh thể Fe các nguyên tử Fe chiếm 74% thể tích.
D nguyên tử Fe=?
Xin cảm ơn trước ạ!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

hể tích của 1 phân tử Fe
V(Fe) = 4π/3. r˄3 = 4π/3 . (1,28.10˄-8)˄3 = 8,78.10˄-24 cm˄3
Thể tích của 1 mol Fe:
V = V(Fe).Na/74% = 8,78.10˄-24.6,022.10˄23/0,74 = 7,15cm˄3
Khối lượng riêng của Fe:
d = 56/7,15 = 7,83g/cm˄3

Chọn A
Thể tích của 1 mol Fe là: 55 , 847 : 7 , 87 = 7 , 096 c m 3
Thể tích của một nguyên tử Fe là:
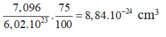
Bán kính gần đúng của nguyên tử Fe là:
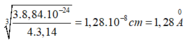

Đáp án C
Giả sử trong 1 mol Fe.
Thể tích thực của Fe là:

Thể tích 1 nguyên tử Fe là:
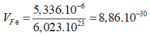
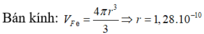

Khối lượng riêng của nguyên tử là:
D = 19,36.100/74 = 26,16(g/ cm 3 )
Khối lượng của 1 mol nguyên tử :
M = V.D.N = 4/3π r 3 .D.N = 4/3. 3,14. 1 , 44 . 10 - 8 3 .26,16. 6,022. 10 23 ≈ 197 (g/mol)

\(V_{1.mol.Ca\left(tinh.thể\right)}=\dfrac{40,08g}{1,55g/cm^3}=25,858cm^3\)
\(V_{thực.sự.1mol.Ca}=25,858.\dfrac{74}{100}=19,135cm^3\)
\(\Rightarrow V_{1.nguyên.tử.Ca}=\dfrac{19,135}{6,023.10^{23}}=3,18.10^{-23}cm^3\)
Giả sử nguyên tử Ca là khối cầu thì: \(V=\dfrac{4}{3}\pi R^3\Rightarrow R=\sqrt[3]{\dfrac{3V}{4\pi}}\)
\(R_{Ca}=\sqrt[3]{\dfrac{3.3,18.10^{-23}}{4.3,14}}=1,97.10^{-8}cm\) hay \(1,97\) \(A^o\)

Nguyên tử khối là 197.
ta có : nguyên tử khối ≈số khối = P+N
số proton = 197 – 118 = 79