để trung hòa dung dich chứa 196g H2SO4 lần 1 người ta cho dung dịch này tác dụng với dung dịch chứa 60g NaOH và lần 2 cho thêm dung dịch Ba(OH)2 . tính khối lượng Ba(OH)2 cần dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
Gọi thể tích hai bazo là V
Suy ra :
n NaOH = 0,1V ; n Ba(OH)2 = 0,15V
n HCl = 0,2.0,2 = 0,04(mol) ; n H2SO4 = 0,2.0,1 = 0,02(mol)
Bản chất của phản ứng là H trong axit tác dụng với OH trong bazo tạo thành nước :
$H + OH \to H_2O$
n H = n HCl + 2n H2SO4 = 0,08(mol)
n OH = n NaOH + 2n Ba(OH)2 = 0,4V
Theo PTHH :
n H = n OH <=> 0,08 = 0,4V <=> V = 0,2(lít)
b) Dung dịch sau pư có :
Na+ : 0,02
Ba2+ :
Cl- : 0,04
Bảo toàn điện tích => n Ba2+ = 0,01(mol)
=> n BaSO4 = n Ba(OH)2 - n Ba2+ = 0,03 - 0,01 = 0,02
m BaSO4 = 0,02.233 = 4,66 gam
vì sao lại có đoạn này vậy ạ :
n H = n HCl + 2n H2SO4 = 0,08(mol)

Ta có: \(C_{\%_{Ba\left(OH\right)_2}}=\dfrac{m_{Ba\left(OH\right)_2}}{250}.100\%=34,2\%\)
=> \(m_{Ba\left(OH\right)_2}=85,5\left(g\right)\)
=> \(n_{Ba\left(OH\right)_2}=\dfrac{85,5}{171}=0,5\left(mol\right)\)
Ta lại có: \(C_{\%_{H_2SO_4}}=\dfrac{m_{H_2SO_4}}{150}.100\%=4,9\%\)
=> \(m_{H_2SO_4}=7,35\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{7,35}{98}=0,075\left(mol\right)\)
a. PTHH; Ba(OH)2 + H2SO4 ---> BaSO4↓ + 2H2O
Ta thấy: \(\dfrac{0,5}{1}>\dfrac{0,075}{1}\)
Vậy Ba(OH)2 dư.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=0,075\left(mol\right)\)
=> \(m_{BaSO_4}=0,075.233=17,475\left(g\right)\)
b. Ta có: \(m_{dd_{BaSO_4}}=250+7,35=257,35\left(g\right)\)
=> \(C_{\%_{BaSO_4}}=\dfrac{17,475}{257,35}.100\%=6,79\%\)

PTHH: \(KOH+HNO_3\rightarrow KNO_3+H_2O\)
\(Ba\left(OH\right)_2+2HNO_3\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\\n_{HNO_3}=\dfrac{189}{63}=3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) HNO3 dư 1 mol
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,5\left(mol\right)\) \(\Rightarrow m_{ddBa\left(OH\right)_2}=\dfrac{0,5\cdot171}{25\%}=342\left(g\right)\)

Ba(OH)2+Na2CO3−−>BaCO3+2NaOH
...0.001......................................0.001...............mol
NaOH+HCl−−>NaCl+H2O
Ba(OH)2+2HCl−−>BaCl2+2H2O
....0.001............0.002................................mol
nHCl=0.1∗0.06=0.006mol
=> nNaOH=0.006−0.002=0.004mol
=> CM từng chất =......

Gọi phần trăm số nguyên tử của \(^{35}Cl\) là x, \(^{37}Cl\)là (100 – x).
Cl2 + H2 ------> 2HCl (1)
\(\overline{M_{Cl}}=\dfrac{35x+37\left(100-x\right)}{100}=35,5\)
=> x = 75
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : 35Cl(75% ); 37Cl(25%).

Số mol H2SO4 = Số mol BaSO4 = 4,66/233 = 0,02
Tổng số mol H+ = 0,08
=>nHCl = 0,08 – 2*0,02 = 0,04
Chọn A

Đáp án A
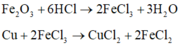
Kết thúc thí nghiệm thu được 2 muối là CuCl2, FeCl2.
1. KHS + KHSO4 → K2SO4 + H2S
Kết thúc thí nghiệm thu được 1 muối là K2SO4
2. CrO3 + H2O → H2CrO4
H2CrO4 + 2NaOH →Na2CrO4 + 2H2O
Kết thúc thí nghiệm thu được 1 muối là Na2CrO4.
3. Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
Kết thúc thí nghiệm thu được 2 muối là FeSO4 và Fe2(SO4)3.
4. Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + NaHSO4 → BaSO4 + NaOH + H2O
Kết thúc thí nghiệm thu được 2 muối là BaSO4 và NaHSO4.
5.
Kết thúc thí nghiệm thu được 2 muối là BaCO4 và NaHCO4.
6. NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O
Kết thúc thí nghiệm thu được 1 muối là BaCO3.
Các thí nghiệm kết thúc có thể thu được 2 muối là: 1, 4, 5, 6.
nH2SO4 = 2
nNaOH = 1.5
2NaOH + H2SO4 = Na2SO4 + 2H2O
1.5--------0.75
2KOH + H2SO4 = K2SO4 + 2H2O
2.5-------1.25
mKOH = 140 => m dd KOH = 350g