Dung dịch NaOH 40% để trung hòa 200ml dung dịch H3PO4 o,5M.
Tính thể tích dung dịch NaOH cần dùng trên, biết khối lượng riêng của Bazơ này là 1,2g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2SO_4}=1.0,2=0,2(mol)\\ PTHH:2NaOH+H_2SO_4\to Na_2SO_4+2H_2O\\ a,n_{NaOH}=0,4(mol);n_{Na_2SO_4}=0,2(mol)\\ \Rightarrow \begin{cases} m_{Na_2SO_4}=0,2.142=28,4(g)\\ m_{dd_{NaOH}}=\dfrac{0,4.40}{20\%}=80(g) \end{cases}\\ b,2KOH+H_2SO_4\to K_2SO_4+2H_2O\\ \Rightarrow n_{KOH}=0,4(mol)\\ \Rightarrow m_{dd_{KOH}}=\dfrac{0,4.56}{5,6\%}=400(g)\\ \Rightarrow V_{dd_{KOH}}=\dfrac{400}{1,045}=382,78(ml)\)
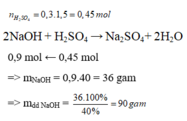
Bước 1: nH2SO4 = VH2SO4 . CM H2SO4= 0,2 . 1 = 0,2mol
Bước 2:
PTHH: 2NaOH + H2SO4 → Na2SO4 + H2O
2 mol 1 mol
? mol 0,2mol
nNaOH=0,2.21=0,4mol.nNaOH=0,2.21=0,4mol.
m NaOH= n NaOH.MNaOH = 0,4 . (23 + 16 + 1) = 16g
Bước 3: C% = mNaOH : m dd NaOH => mdd NaOH = mNaOH : C% = 16 : 20% = 80g

nH2SO4=0.75(mol)
H2SO4+2KOH->K2SO4+2H2O
nKOH=2 nH2SO4->nKOH=1.5(mol)
mKOH=84(g)
mdd=84*100:25=336(g)
H2SO4+2NaOH->Na2SO4+2H2O
nNaOH=1.5(mol) ->mNaOH=60(g)
mdd NaOH=60*100:15=400(g)
V NaOH=400:1.05=381(ml)
Bạn xem lại xem 100 ml hay 1000 ml nhé ^^ tại mình thấy số mol hơi lớn

a)
Gọi thể tích hai bazo là V
Suy ra :
n NaOH = 0,1V ; n Ba(OH)2 = 0,15V
n HCl = 0,2.0,2 = 0,04(mol) ; n H2SO4 = 0,2.0,1 = 0,02(mol)
Bản chất của phản ứng là H trong axit tác dụng với OH trong bazo tạo thành nước :
$H + OH \to H_2O$
n H = n HCl + 2n H2SO4 = 0,08(mol)
n OH = n NaOH + 2n Ba(OH)2 = 0,4V
Theo PTHH :
n H = n OH <=> 0,08 = 0,4V <=> V = 0,2(lít)
b) Dung dịch sau pư có :
Na+ : 0,02
Ba2+ :
Cl- : 0,04
Bảo toàn điện tích => n Ba2+ = 0,01(mol)
=> n BaSO4 = n Ba(OH)2 - n Ba2+ = 0,03 - 0,01 = 0,02
m BaSO4 = 0,02.233 = 4,66 gam
vì sao lại có đoạn này vậy ạ :
n H = n HCl + 2n H2SO4 = 0,08(mol)

nNa2O = 0,125 mol
a. Na2O + H2O --------> NaOH
0,125 mol ----------------> 0,125 mol
--> CM(NaOH) n/V = 0,125/ 0,25 = 0,5 M
b. H2SO4 + 2NaOH ------> Na2SO4 + H2O
....0,0625 <---0,125 mol
--> mH2SO4(nguyên chất) = 0,0625*98 = 6,125 g
--> mH2SO4(20%) = 6,125/20% = 30,625 g
suy ra V = m/D = 30,625 / 1,14 = 26,86 ml
nNa2O = 0,125 mol
a. Na2O + H2O --------> NaOH
0,125 mol ----------------> 0,125 mol
--> CM(NaOH) n/V = 0,125/ 0,25 = 0,5 M
b. H2SO4 + 2NaOH ------> Na2SO4 + H2O
....0,0625 <---0,125 mol
--> mH2SO4(nguyên chất) = 0,0625*98 = 6,125 g
--> mH2SO4(20%) = 6,125/20% = 30,625 g
suy ra V = m/D = 30,625 / 1,14 = 26,86 ml


\(n_{H_3PO_4}=0.2\cdot0.5=0.1\left(mol\right)\)
\(3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\)
\(0.3..............0.1\)
\(m_{dd_{NaOH}}=\dfrac{0.3\cdot40}{40\%}=30\left(g\right)\)
\(V_{dd_{NaOH}}=\dfrac{30}{1.2}=25\left(ml\right)\)
PTHH: \(3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\)
Ta có: \(n_{H_3PO_4}=0,5\cdot0,2=0,1\left(mol\right)\) \(\Rightarrow n_{NaOH}=0,3\left(mol\right)\)
\(\Rightarrow m_{ddNaOH}=\dfrac{0,3\cdot40}{40\%}=30\left(g\right)\) \(\Rightarrow V_{ddNaOH}=\dfrac{30}{1,2}=25\left(ml\right)\)