1 loại đá chứa CaCO3 và MgCO3 hòa tan hết bằng 400 ml HNO3 thu 6.72 l CO2(ĐKTC). Cho dung dịch sau phản ứng tác dụng vừa đủ với 100 g NaOH 8 phần trăm để trung hòa dung dịch thu được rồi cô cạn được 63 g muối khan. Tính khối lượng mỗi chất, viết công thức của đá và CM HNO3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
* Hỗn hợp gồm kim loại M, Fe, FeCO3 tác dụng với dung dịch HNO3 thu được 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí nên 2 khí là NO và CO2
Tính được nCO2=0,05 mol, n(NO)=0,15 mol nên n(FeCO3)=n(CO2)=0,05 mol.
Đặt nM=a mol, nên n(Fe)=b mol. Ta có: aM+56b+116.0,05=14,1
Nên aM+56b=8,3 (1)
- Dung dịch X2 có : a mol M(NO3)n; (b+0,05) mol Fe(NO3)3, HNO3 dư, có thể có c mol NH4NO3.
+ Phản ứng trung hòa:
HNO3+NaOH→NaNO3+H2O
n(NaOH)= n (HNO3dư)=0,2.1=0,2 mol
- dung dịch X3 có a mol M(NO3)n,( b+0,05) mol Fe(NO3)3, 0,2 mol NaNO3, có thể c mol NH4NO3.
* Cô cạn ½ dung dịch X3, tổng khối lượng chất rắn thu được là:
(M+62n)a+242(b+0,05)+80.c+85.0,2=38,3.2=76,6
aM+62an+242b+80c=47,5 (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
Fe(NO3)3+3NaOH→3NaNO3+Fe(OH)3
Ta có: 107(b+0,05)=16,05 suy ra b=0,1
Theo bảo toàn electron, ta có: an+ 0,3+0,05=0,45+8c suy ra an=0,1+8c (5)
Từ (1) suy ra aM=2,7 (6)
Từ (2) aM+62an+80c=23,3 (7)
Từ (5), (6), (7) an=0,3; c=0,025 M=9n n=3; M=27 là Al là nghiệm thỏa mãn.
n(HNO3 phản ứng)=nN(sp)=0,1.3+0,15.3+0,025.2+0,15=0,95mol
n(HNO3 bắt đầu)=0,95+0,2=1,15 mol x= CM(HNO3)=2,3M.

Chọn đáp án D.
► Xét thí nghiệm 1:
Quy quá trình về: X + 0,04 mol HCl + 0,08 mol NaOH.
⇒ nX = 0,08 – 0,04 = 0,04 mol
⇒ 250 ml dung dịch X chứa 0,2 mol H2RCOOH.
⇒ Mmuối = 35 ÷ 0,2 = 175 (H2NRCOOK)
⇒ R = 76 (-C6H4-)

Chọn đáp án D
► Xét thí nghiệm 1: Quy quá trình về: X + 0,04 mol HCl + 0,08 mol NaOH.
⇒ nX = 0,08 – 0,04 = 0,04 mol ⇒ 250 ml dung dịch X chứa 0,2 mol H2RCOOH.
||⇒ Mmuối = 35 ÷ 0,2 = 175 (H2NRCOOK) ⇒ R = 76 (-C6H4-) ⇒ chọn D.

MgCO3 ----> MgO + CO2
CaCO3 -----> CaO + CO2
0,15 (mol) <------------ 0,15 (mol) (1) đây ý nói là tổng lượng mol CO2 = tổng lượng hỗn hợp muối
MgCO3 + HCl -------> MgCl2 + CO2 + H20
CaCO3 + HCl --------> CaCl2 + CO2 + H20
=> n(MgCO3,CaCO3) = n(MgCl2,CaCl2) = 0,15 (mol)
=> M(MgCl2,CaCl2) = 317/3
Sau đó, ta đặt: C (là phần trăm của CaCl2 trong hỗn hợp muối)
1-C (là phần trăm của MgCl2 trong hỗn hợp muối)
Với C là 100% trong hỗn hợp đó
=> 111C + 95x(1-C) = 317/3
Từ đó suy ra: C= 2/3
Vì lượng muối trong hỗn hợp tác dụng với HCl bằng lượng từng muối trong hỗn hợp ban đầu nên
%CaCO3 = 2/3x100% = 66,667%
%MgCO3 = 1/3x100% = 33,33%

Đáp án D
Dung dịch X + vừa đủ 0,25 mol NaOH sinh ra 0,12 mol Mg(OH)2.
+ Nhận thấy để tạo 0,12 mol Mg(OH)2 cần dùng 0,24 mol NaOH < 0,25 mol NaOH cần dùng vừa đủ.
Mà đề nói hỗn hợp M tác dụng vừa đủ với axit HNO3 ⇒ HNO3 không thể dư được.
⇒ Chỉ có 1 cách giải thích thỏa đáng đó là nNH4NO3 = 0,25 – 0,24 = 0,01 mol.
Vậy ta có sơ đồ:
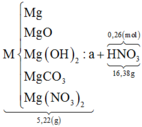
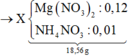
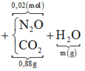
Vì 2 khí có cùng phân tử khối là 44 ⇒ mKhí = 0,02×44 = 0,88 gam.
mMuối = 0,12×148 + 0,01×80 = 18,56 gam.
Vậy bảo toàn khối lượng ta ⇒ mH2O = m = 2,16 gam ⇒ nH2O = 0,12 mol.
ĐẶt nMg(OH)2 = a và bảo toàn hiđro cả quá trình ta có:
2a + 0,26 = 0,01×4 + 0,12×2 ⇔ a = 0,01 mol.
⇒ mMg(OH)2 = 0,01×58 = 0,58 gam.
⇒ %mMg(OH)2 = 0 , 58 × 100 5 , 22 ≈ 11,11%

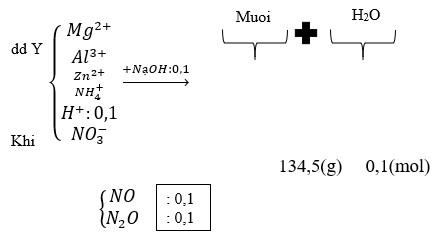

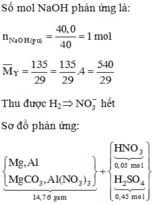
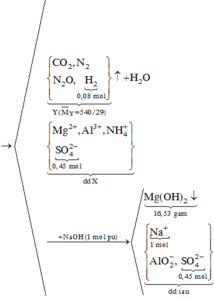
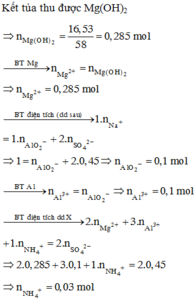
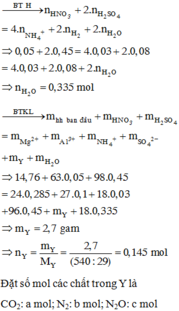

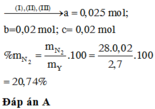
Gọi số mol MgCO3,CaCO3 là a,b
=> aCO3 + 2HNO3 → a(NO3)2 + H2O + CO2.
Lập hệ phương trình: \(\begin{cases}148a+164b=46\\a+b=0,3\end{cases}\) \(\Rightarrow\begin{cases}a=0,2\\b=0,1\end{cases}\)
giải rõ hơn cho mình với