Cho 12.6 (g) hỗn hợp Mg và Al theo thỉ lệ mol 3:2 tác dụng với H2SO4 đặc nóng vừa đủ thu đc 0,15 mol sản phẩm?
khử duy nhất là lưu huỳnh..Xác định sản phẩm trên là SO2,S hay H2SHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C.
Bảo toàn e ta có:
nMg.2 + nAl.3 + nZn.2 = nspk.x (x là số e thay đổi của sản phẩm khử)
0,08.2 + 0,08.3 + 0,08.2 = 0,07. x => x = 8 => Sản phẩm khử là H2S

Mg0 ---> Mg2+ + 2e
x............................2x
Al0 ---> Al3+ + 3e
y........................3y
tỉ lệ mol : \(\dfrac{x}{y}=\dfrac{3}{2}=>2x-3y=0\left(1\right)\)
24x + 27y = 6,3 (2)
=> x= 0,15 ; y=0,1
ne(nhường) = 2x + 3y = 0,6
ne(nhận) = 0,075
=> số oxh của spk là : 0,6 : 0,075 = 8
=> X là H2S

Ta có: 56nFe + 27nAl = 8,3 (1)
\(n_{SO_2}=\dfrac{7,427}{24,79}=0,3\left(mol\right)\)
Theo ĐLBT e, có: 3nFe + 3nAl = 2nSO2 = 0,6 (2)
Từ (1) và (2) ⇒ nFe = nAl = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{8,3}.100\%\approx67,47\%\\\%m_{Al}\approx32,53\%\end{matrix}\right.\)

Đáp án B

→ 45 , 2 g c r Y → + H 2 S O 4 0 , 35 m o l S O 2
Giả sử chất rắn Y gồm Ag (a mol), Cu (2a mol)
m Y = m Ag + m Cu ⇔ 108 a + 64 . 2 a = 45 , 2 ⇔ a = 0 , 192 mol
n e n h ư ờ n g = n A g + 2 n C u = 0 , 192 + 2 . 2 . 0 , 192 = 0 , 96 > 2 n S O 2 = 2 . 0 , 35 = 0 , 7 m o l
=> Mg và Al phản ứng hết và Cu2+ dư.
Ta có hệ pt:
108 n Ag + 64 n Cu = 45 , 2 n Ag + 2 n Cu = 2 n SO 2 = 0 , 7 ⇔ n Ag = 0 , 3 = a n Cu = 0 , 2
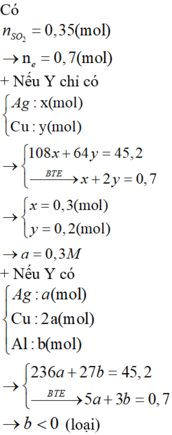


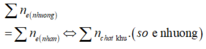
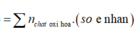
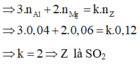

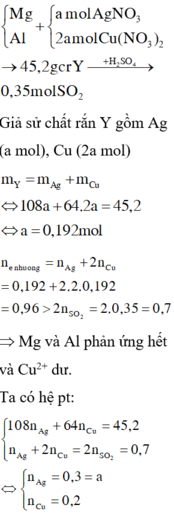
n Mg = a
n Al = b
=> 24a + 27b = 12,6
Tỉ lệ mol => 2a - 3b = 0
Tìm dc a = 0,3 và b = 0,3
Tổng mol e nhường = 0,2*2 + 0,3*3 = 1,2
Tổng mol e nhận: 0,15
=> số oxh của spk của pứ = 1,2 / 0,15 = 8
=> H2S
( S[+6] + 8e = S[-2] )
n Mg = a
n Al = b
=> 24a + 27b = 12,6
Tỉ lệ mol => 2a - 3b = 0
Tìm dc a = 0,3 và b = 0,3
Tổng mol e nhường = 0,2*2 + 0,3*3 = 1,2
Tổng mol e nhận: 0,15
=> số oxh của spk của pứ = 1,2 / 0,15 = 8
=> H2S
( S[+6] + 8e = S[-2] )