Hòa tan hoàn toàn 16.6 g hỗn hợp sắt và nhôm bằng dung dịch HCl 14.6%. Sau phản ứng thu được 11.2 lít khí H2 ( đktc)
a. Tính thành phần % về khối lượng của nhôm và sắt trong hỗn hợp ban đầu
b. Tính khối lượng của dung dịch HCl 14.6 % đã dùng
c. Tính nồng độ % của dung dịch muối thu được

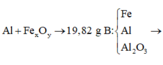
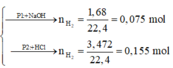
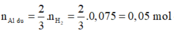
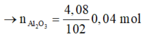


PTHH: Fe + 2HCl → FeCl2 + H2 ↑
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Gọi số mol của Fe là a, số mol của Al là 2b => Số mol của H2 ở pt (1) là a , số mol H2 ở pt (2) là 3b
Số mol của khí H2 sinh ra là: 11,2 : 22,4 = 0,5 mol
a) Ta có hệ phương trình:
=> a = 0,2 , b = 0,1
Khối lượng của sắt là: 56a = 56. 0,2 = 11,2 (gam)
%Fe là: (11,2 : 16,6).100% = 67,47%
Khối lượng của nhôm là: 54b = 54. 0,1 = 5,4 (gam)
%Al là: (5,4 : 16,6).100% = 32,53%
b) Khối lượng của HCl là: 2a+6b = 1 (mol)
Khối lượng của HCl là: 1 . 36,5 = 36,5 (gam)
Khối lượng dung dịch HCl là: 36,5 : 14,6% = 250 (g)
c) Khối lượng FeCl2 là: 127 . 0,2 = 25,4 (gam)
Khối lượng AlCl3 là: 133,5 . 2 . 0,1 = 26,7 (gam)
Sau đó áp dụng định luật bảo toàn khối lượng:
Khối lượng dung dịch muối thu được là:
16,6 + 250 - ( 0,5 . 2) = 265,6(gam)
Nồng độ phần trăm FeCl2 trong dung dịch muối là:
(25,4 : 265,6) . 100% = 9,564%
Nồng độ phần trăm AlCl3 trong dung dịch muối là:
( 26,7 : 265,6 ) . 100% = 10,06%
gọi x,y là số mol của Fe và Al trong hỗn hợp
nH2=0,4mol
PTHH: 2Al+6HCl=>2AlCl3+3H2
y---------------------->1,5y
Fe+2HCl=> FeCl2+H2
x-------------------->x
ta có hệ :\(\begin{cases}56x+27y=16,6\\x+1,5y=0,5\end{cases}\)<=> x=0,2 và y=0,2
=> mFe=0,2.56=11,2g
=> %mFe=67,47%
=> %mAl=32,53%
m(HCl)=(0,2+0,2).36,5=14,6g
=> khối lượng dung dịch đã dùng là : 146g