Đốt cháy hoàn toàn 0,74 g chất rắn X cần 1,12 lít không khí chứa 20% thể tích oxi. Sản phẩm đốt cháy gồm 224cm3 CO2, 0,53g Na2CO3 và H2O. Xác định công thức phân tử đơn giản của A biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CÂU 2) Nguyên tố hh là :
a. yếu tố cơ bản cấu tạo nên nguyên tử
b. phần tử cơ bản tạo nên vật chất
c. ngyên tử cùng loại
d. phần tử chính cấu tạo nên nguyên tử
Câu 1 :
\(V_{kk}=1.12\left(l\right)\)
\(\Rightarrow n_{O_2}=\dfrac{1.12}{22.4}\cdot20\%=0.01\left(mol\right)\)
\(n_{CO_2}=\dfrac{0.224}{22.4}=0.01\left(mol\right)\)
\(n_{Na_2CO_3}=\dfrac{0.53}{106}=0.005\left(mol\right)\)
\(BTKL:\)
\(m_{H_2O}=0.74+0.01\cdot32-0.01\cdot44-0.53=0.09\left(g\right)\)
\(n_{H_2O}=\dfrac{0.09}{18}=0.005\left(mol\right)\)
\(m_{O\left(X\right)}=0.74-0.015\cdot12-0.005\cdot2-0.005\cdot2\cdot23=0.32\left(g\right)\)
\(n_O=0.02\left(mol\right)\)
\(CT:C_xH_yO_zNa_t\)
\(x:y:z:t=0.015:0.01:0.02:0.01=3:2:4:2\)
\(CT:C_3H_2O_4Na_2\)

Theo định luật bảo toàn khối lượng :
![]()
Đặt số mol C O 2 là a, số mol N2 là b, ta có :
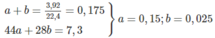
Khối lượng C: 0,150 x 12,0 = 1,80 (g).
Khối lượng H: 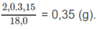
Khối lượng N: 0,0250 x 28,0 = 0,700 (g).
Khối lượng O: 4,48 - 1,80 - 0,35 - 0,700 = 1,60 (g).
Chất A có dạng C x H y N z O t
x : y ; z : t = 0,15 : 0,35 : 0,05 : 0,10 = 3 : 7 : 1 : 2
Công thức đơn giản nhất của A là C 3 H 7 N O 2

$n_{O_2} = \dfrac{1,12}{22,4}.20\% = 0,01(mol)$
$n_{CO_2} = \dfrac{244}{1000.22,4} = 0,01(mol)$
$n_{Na_2CO_3} = 0,005(mol)$
Bảo toàn khối lượng : $n_{H_2O} = \dfrac{0,74 + 0,01.32 - 0,01.44 - 0,53}{18} = 0,005(mol)$
Ta có :
$n_C = n_{CO_2} + n_{Na_2CO_3} = 0,015(mol)$
$n_H = 2n_{H_2O} = 0,01(mol)$
$n_O = 0,01.2 + 0,005.3 + 0,005 - 0,01.2 = 0,02(mol)$
$n_{Na} = 2n_{Na_2CO_3} = 0,005.2 = 0,01(mol)$
Ta có:
$n_C : n_H : n_O : n_{Na} = 0,015 : 0,01 : 0,02 : 0,01 = 3 : 2 : 4 : 2$
Vậy A có CTĐGN là $C_3H_2O_4Na_2$

1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
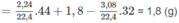
Khối lượng C trong 1,8 g A là: 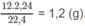
Khối lượng H trong 1,8 g A là: 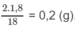
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
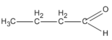 (butanal)
(butanal)
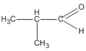 (2-metylpropanal)
(2-metylpropanal)
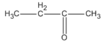 (butan-2-ol)
(butan-2-ol)

Đáp án C
Gọi công thức phân tử của X là CxHyNt
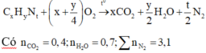
![]()
Mà thể tích trong không khí của O2 và N2 lần lượt là 20% và 80%
![]()
![]()
![]()
![]()
Vì CTĐGN của X cũng là CTPT
Nên CTPT của X là C2H7N

a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)

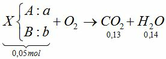
Đốt cháy ankin => nCO2 > nH2O mà theo bài ra nCO2 < nH2O
=> B là ankan nCO2 < nH2O
Nhận xét:
Đốt ankin: – nankin = nH2O – nCO2
Đốt ankan: nankan = nH2O – nCO2
=> b – a = 0,01 và b + a = 0,05
=> a = 0,02 và b = 0,03
=> số C trung bình = 2,6 và số H trung bình = 5,6
TH1: số C trong ankin < 2,6 => A là C2H2: 0,02 và B: 0,03
=> B: 44 (C3H8)
TH2: số C trong ankan < 2,6 => A : 0,02 và CH4: 0,03
=> A: 68 (C5H8) loại do hh khí
TH3: số C trong ankan < 2,6 => A: 0,02 và C2H6: 0,03
=> A: 47 (lẻ) => loại
Vậy A là C2H2 (axetilen/ etin) và B là C3H8 (propan)

Đáp án A
,nO2 = 0,1875 mol
Bảo toàn khối lượng : mA + mO2 = mCO2 + mN2 + mH2O
=> mCO2 + mN2 = 7,3g
Mặt khác : nCO2 + nN2 = 0,175 mol
=> nCO2 = 0,15 ; nN2 = 0,025 mol
Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol
=> nC : nH : nO : nN = 0,15 : 0,0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1
Vì A chỉ có 1 nguyên tử N nên A có CTPT là : C3H7O2N

\(n_{O_2}=\frac{22,4}{22,4}=1mol\)
BT O: \(n_{CO_2}+0,5n_{H_2O}=n_{O_2}=1\)
Mà \(n_{CO_2}:n_{H_2O}=1:2\)
\(\rightarrow n_{CO_2}=0,5mol\) và \(n_{H_2O}=1mol\)
BT C và H: \(n_C=n_{CO_2}=0,5mol\) và \(n_H=2n_{H_2O}=2mol\)
Có \(m_C+m_H=0,5.12+2=8=m_A\)
Vậy A chỉ chứa C và H
\(\rightarrow n_C:n_H=0,5:2=1:4\)
Vậy CTPT của A có dạng là \(\left(CH_4\right)_n\)
Mà \(M_A=M_{H_2}.8=16\)
\(\rightarrow\left(12+4\right).n=16\)
\(\rightarrow n=1\)
Vậy CTPT của A là \(CH_4\)
1,12 dm3= 1,12 lit
224cm3 = 0.224lit
n(kk)= 1,12/ 22,4 =0,05 mol
n (O2)= 0,05x 20%= 0,01 mol
n(CO2)= 0,01 mol
n(Na2CO3) = 0,005 mol
suy ra
m( sản phẩm)= m ( chất phản ứng) = 0,74 + 0,01x 32=1,06 g
m(H2O)= 1,06 – 0,01x 44 – 0,53= 0,09g
n(H2O)=0,005 mol
vì đốt A tạo ra CO2 Na2CO3 và H2O nên trong A có Na, C, H và có thể có O
Ta có:
nO ( có trong sản phẩm) = 0,01x2 + 0,005x3 +0,005= 0,04 mol > nO (O2)= 0,01x2=0,02 mol
trong A có O
nO (A) = 0,04- 0,02 = 0,02 mol
n Na(A) = 0,005x2= 0,01 mol
nH(A)=0,005x2= 0,01 mol
nC (A)= 0,01 + 0,005= 0,015mol
nNa : nH : nC : nO= 0,01: 0,01: 0,015 : 0,02