trộn 120ml dd H2SO4 với 40ml dd KOH. DD sau khi trộn chỉ chứa 1 muối axit và còn dư H2SO4 0,1M. Mặt khác, nếu trộn 40ml dd H2SO4 với 60ml dd KOH thì dd sau khi trộn chỉ chứa 1 muối trung hòa và còn dư KOH 0,16M. Xác định CM của 2 dd ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi a,b lần lượt là CM của H2SO4 và NaOH
Thí nghiệm 1: bazơ hết, axit dư
H2SO4 + NaOH -> NaHSO4 + H2O
0,12a -> 0,04b
nH2SO4 dư = 0,1*(0,12 + 0,04) = 0,016 (mol)
Ta có: 0,12a - 0,04b = 0,016 (1)
Thí nghiệm 2: bazơ dư, axit hết
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
0,04a -> 0,06b
0,04a -> 0,08a
nNaOH dư = 0,16 *(0,04 + 0,06) = 0,016 (mol)
Vậy 0,06b - 0,08a = 0,016 (2)
Từ (1) và (2), ta được:
x = 0,4
y = 0,8
Vậy CM H2SO4 = 0,4M
CM NaOH = 0,8M
Đặt x ; y là nồng độ mol của H2SO4 và NaOH
Phần đầu
NaOH + H2SO4 --> NaHSO4 + H2O
0,04y 0,12x
n H2SO4 dư = 0,1.( 0,12 + 0,04 ) = 0,016 (mol)
=> 0,12x - 0.04y = 0,016 (1)
Phần sau
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,06y 0,04x
0,08x <-----0,04x
n NaOH dư = 0,16( 0,04 + 0,06 ) = 0,016 (mol)
=> 0,06y - 0,08x = 0,016 (2)
Từ (1) ; (2) lập hệ pt :
{ 0,12x - 0.04y = 0,016
{0,06y - 0,08x = 0,016
{ x = 2/5
{ y = 4/5

Gọi a, b là CM của H2SO4, NaOH.
+ TN1: NaOH pứ hết, H2SO4 dư
nH2SO4 = 0.12a => nH+ = 0.24a
nNaOH = 0.04b => nOH- = 0.04b
nH2SO4 dư = 0.1*(0.12 + 0.04) = 0.016 => nH+ dư = 0.032
2H+ ... +.... OH- + SO4(2-) -----> HSO4- + H2O
0.08b.........0.04b
nH+ dư = 0.24a - 0.08b = 0.032 (1)
+ TN2: H2SO4 pứ hết, NaOH dư
nH2SO4 = 0.04a => nH+ = 0.08a
nNaOH = 0.06b => nOH- = 0.06b
nNaOH dư = 0.16*(0.04 + 0.06) = 0.016 => nOH- dư = 0.016
H+ + OH- ------> H2O
0.08a....0.08a
=> nOH- dư = 0.06b - 0.08a = 0.016 (2)
Từ (1) và (2) => a = 0.4, b = 0.8

75873.html có câu hỏi tương tự đây , lần sau phải tìm kiếm câu hỏi tương tự trc chứ !

nNa+ = 0,016 mol
Gọi số mol của Cl- và SO42- lần lượt là a, b
Bảo toàn điện tích: a + 2b = 0,016 (1)
Từ khối lượng muối: 35,5a + 96b = 1,036 - 0,016.23 = 0,668 (2)
Từ (1), (2) suy ra: nCl- = 0,008 mol ; nSO42- = 0,004 mol
=> CmHCl = 0,8 M ; CmH2SO4 = 0,4 M

+nHCl=0.2*0.4=0.08(mol)
=>nH{+}=0.08(mol)
+nHNO3=0.1*0.4=0.04(mol)
=>nH{+}=0.04(mol)
+nH2SO4=0.15*0.4=0.06(mol)=nSO4{2-}
=>nH{+}=0.06*2=0.12(mol)
=>nH{+}(tổng)=0.08+0.04+0.12=0.24(mol)
+nNaOH=0.2*10^-3V(mol)
=>nOH{-}=2*10^-4V(mol)
+nBa(OH)2=0.05*10^-3V(mol)=nBa{2+}
=>nOH{-}=2*5*10^-5V=10^-4V(mol)
=>nOH{-}(tổng)=2*10^-4V+10^-4V=3*10^-4...
_Sau phản ứng thu được dung dịch có pH=13=>môi trường có tính bazơ.
=>pOH=14-13=1=>[OH-] dư=10^-1(M)
=>nOH{-} dư=10^-1*(0.4+10^-3V)(mol)
H{+}+OH{-}=>H2O
0.24->3*10^-4V...(mol)
0.24->0.24...........(mol)
0------>3*10^-4V-0.24.(mol)
=>3*10^-4V-0.24=0.04+10^-4V
<=>2*10^-4V=0.28
<=>V=1400(ml)
Vậy cần V=1400 ml
_Sau phản ứng kết tủa tạo thành là BaSO4:
+nBa{2+}=5*10^-5*(1400)=0.07(mol)
+nSO4{2-}=0.06(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.07>0.06----------->0.06(mol)
=>mBaSO4=0.06*233=13.98(g)

đặt nồng độ mol của dd a là a , dd b la b. khi trộn 3 l a (có 3a mol) với 2 lit b (có 2b mol) được 5 lit dd x có dư axit. trung hoà 5 lit dd x cần
nKOH =0,2.5 = 1mol -> số mol H2SO4 dư: 0,5 mol.
H2SO4+ 2KOH -> K2SO4 +2 H2O
b-------------- 2b
số mol h2so4 dư = 3a – b = 0,5*
trộn 2l dd a (có 2a mol) với 3 lít ddb (có 3b mol) tạo 5 l dd y có koh dư. trung hoà 5 lit y cần 0,2 .5 = 1 mol hcl
pt: H2SO4 + 2KOH -> K2SO4 + 2H2O
2a---------------- 4a
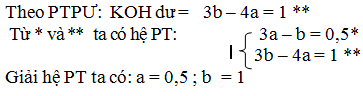

Gọi a, b là CM của H2SO4, NaOH.
+ TN1: NaOH pứ hết, H2SO4 dư
nH2SO4 = 0.12a => nH+ = 0.24a
nNaOH = 0.04b => nOH- = 0.04b
nH2SO4 dư = 0.1*(0.12 + 0.04) = 0.016 => nH+ dư = 0.032
2H+ ... +.... OH- + SO4(2-) -----> HSO4- + H2O
0.08b.........0.04b
nH+ dư = 0.24a - 0.08b = 0.032 (1)
+ TN2: H2SO4 pứ hết, NaOH dư
nH2SO4 = 0.04a => nH+ = 0.08a
nNaOH = 0.06b => nOH- = 0.06b
nNaOH dư = 0.16*(0.04 + 0.06) = 0.016 => nOH- dư = 0.016
H+ + OH- ------> H2O
0.08a....0.08a
=> nOH- dư = 0.06b - 0.08a = 0.016 (2)
Từ (1) và (2) => a = 0.4, b = 0.8
có phải là lp 6 thiệt ko, hơi bj nghi ngờ đó, hóa lp 8 chứ ko ít