Cho 4,48 lit \(CO_2\) (đktc) đi qua 190,48ml dung dịch \(NaOH\) 0,02 phần trăm có khối lượng riêng là 1,05g/ml . Hãy cho biết muối nào được tạo thành và khối lượng là bao nhiêu gam ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n CO2=\(\frac{4,48}{22,4}\)=0,1 (mol)
m dd NaOH= 1,05 . 190,48= 200 (g)
==> m NaOH=200 . 0,02%=0,04(g)
---->n NaOH = \(\frac{0,04}{40}\)=0,001 (mol)
CO2 + 2NaOH ------> Na2CO3 + H2O
ban đầu 0,1 0,001 !
pư 0,000 <------- 0,001 -------> 0,001 ----> 0,001 ! (mol)
Sau pư 0,0995 0 0,001 0,001 !
vì sau pư CO2 còn dư nên có thêm pt xảy ra
CO2 + Na2CO3 + H2O -------> 2NaHCO3
ban đầu 0,0995 0,001 !
pư 0,001 <------ 0,001 -----> 0,002 ! (mol)
Sau pư 0,0985 0 0,002 !
sau pư, muối tạo thành là muối axit
m NaHCO3 = 0,002 . 84= 0,168(g)

nCO2=0,2 , mNaOH=(0,02*190,48*1,05)/100=0,04 gam
=>nNaOH=0,001
nNaOH/nCO2=0,005<1 => tạo ra muối NaHCO3
NaOH+ CO2---> NaHCO3
0,001---------------0,001 mol
=> mmuối=0,084 gam
nCO2=0,2mol, nNaOH=0,001mol
-->muối tạo thành là NaHCO3
mNaHCO3=0,084g
10.
nCO2=0,11mol
gọi nNaHCO3=x, nNa2CO3=y
84x+106y=9,46
x+y=0,11
-->x=0,1, y=0,01
-->mNaHCO3=8,4g, mNa2CO3=1,06g
nNaOH=0,12mol
nCO2 bđ=0,11mol mà để thu được NaHCO3 thì cần có nOH-/nCO2 <1
-->cần thêm ít nhất 0,01mol CO2 nữa để thu được mình muối NaHCO3

* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
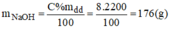
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
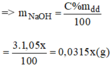
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
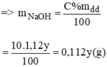
Ta có hệ phương trình sau: 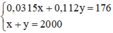
Giải hệ phương trình trên, ta được: 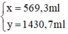
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

Đáp án C
Bảo toàn e : 2nCu = 2nSO2 => nSO2 = 0,2 mol
nNaOH = 0,4 mol = 2nSO2
=> Chỉ có phản ứng : 2NaOH + SO2 -> Na2SO3 + H2O
=> mNa2SO3 = 25,2g

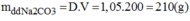
Nồng độ phần trăm của dung dịch pha chế:
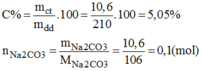
Nồng độ mol của dung dịch:
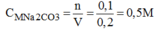

nZn = 13/65 = 0,2 (mol)
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
LTL: 0,2/2 < 0,2 => O2 dư
nO2 (p/ư) = 0,2/2 = 0,1 (mol)
mO2 (dư) = (0,2 - 0,1) . 32 = 3,2 (g)
nZnO = nZn = 0,2 (mol)
mZnO = 0,2 . 81 = 16,2 (g)

Ta có: \(m_{dd}=300\cdot1,05=315\left(g\right)\) \(\Rightarrow C\%_{Na_2CO_3}=\dfrac{15,9}{315}\cdot100\%\approx5,05\%\)
Mặt khác: \(n_{Na_2CO_3}=\dfrac{15,9}{106}=0,15\left(mol\right)\) \(\Rightarrow C_{M_{Na_2CO_3}}=\dfrac{0,15}{0,3}=0,5\left(M\right)\)

a) \(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{NaOH}=0,3.1=0,3\left(mol\right)\)
Xét tỉ lệ \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,3}{0,2}=1,5\)
=> Tạo ra muối NaHCO3, Na2CO3
b)
PTHH: 2NaOH + CO2 --> Na2CO3 + H2O
0,3----->0,15------>0,15
Na2CO3 + CO2 + H2O --> 2NaHCO3
0,05<---0,05---------------->0,1
=> \(\left\{{}\begin{matrix}m_{Na_2CO_3}=\left(0,15-0,05\right).106=10,6\left(g\right)\\n_{NaHCO_3}=0,1.84=8,4\left(g\right)\end{matrix}\right.\)
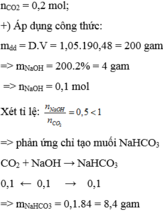
nCO2=0,2mol, nNaOH=0,001mol
bạn lập tỉ lệ
-->muối tạo thành là NaHCO3
mNaHCO3=0,084g
Bạn ơi ! bạn chỉ giúp mình làm sao để tính n của NaOH