Trong 800 ml của một dung dịch có chứa 8g NaOH a, Hãy tính nồng độ mol của dung dịch này. b, Phải thêm bao nhiêu ml nước vào 200ml dung dịch này để được dung dịch NaOH 0,1M?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Số mol của NaOH là:
n = 0,2 mol
Nồng độ mol của dung dịch là:
CM = = 0,25 M
b. Thể tích nước cần dùng:
- Số mol NaOH có trong 200 ml dung dịch NaOH 0,25 M:
nNaOH = = 0,05 mol
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 NaOH
Vdd = = 500 ml
Vậy thể tích nước phải thêm là:
= 500 – 200 = 300 ml
a) Số mol của NaOH là:
n = 0,2 mol
Nồng độ mol của dung dịch là:
CM = = 0,25 M
b. Thể tích nước cần dùng:
- Số mol NaOH có trong 200 ml dung dịch NaOH 0,25 M:
nNaOH = = 0,05 mol
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 NaOH
Vdd = = 500 ml
Vậy thể tích nước phải thêm là:
= 500 – 200 = 300 ml
Xem thêm tại: http://loigiaihay.com/bai-4-trang-151-sgk-hoa-hoc-8-c51a10352.html#ixzz49UQu5vYO

a)
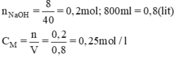
b) nNaOH có trong 200ml dung dịch NaOH 0,25M là

VH2O cần dùng để pha loãng 200ml dung dịch NaOH 0,25M để dung dịch NaOH 0,1M.
VH2O = 500 - 200 = 300ml H2O.

a) Ta có: 800ml=0,8 lít
nNaOH=m/M=8/40=0,2 (mol)
=> CM=\(\dfrac{n}{V}=\dfrac{0,2}{0,8}=0,25\left(M\right)\)
b) Ta có: 200ml=0,2 lít
=> nNaOH=CM.V=0,1.0,5=0,05 (mol)
Gọi x là sô gam nước cần thêm vào:
=> \(0,1=\dfrac{0,05}{x}\)
=> x=0,5 lít =500ml
Vậy cần phải thêm vào 500 - 200 =300 ml nước
a)đổi 700ml=0,8 lít
nNaOH=8/40=0,2mol
CM=n/V=0,2/0,8=0,25M
b) đổi 200ml=0,2 lít
nNaOH=0,25.0,2=0,05mol
gọi x là số gam nước cần thêm vào
=> \(0,1=\dfrac{0,05}{x}=>x=0,5\) ( lít )=500ml
Vậy cần thêm vào 500-200=300ml nước

\(a,m_{KOH}=\dfrac{28.10}{100}=2,8\left(g\right)\\ \rightarrow n_{KOH}=\dfrac{2,8}{56}=0,05\left(mol\right)\\ b,C\%=\dfrac{36}{144+36}.100\%=20\%\\ c, n_{NaOH}=\dfrac{0,8}{40}=0,02\left(mol\right)\\ \rightarrow C_{M\left(NaOH\right)}=\dfrac{0,02}{0,08}=0,25M\)
\(a,m_{KOH}=\dfrac{28.10}{100}=2,8\left(g\right)\\ n_{KOH}=\dfrac{2,8}{56}=0,05\left(mol\right)\\ C\%=\dfrac{36}{36+144}.100\%=20\%\\ C_M=\dfrac{0,8}{0,08}=10M\)

Bài giải:
a) Số mol của NaOH là:
n = 0,2 mol
Nồng độ mol của dung dịch là:
CM = = 0,25 M
b. Thể tích nước cần dùng:
- Số mol NaOH có trong 200 ml dung dịch NaOH 0,25 M:
nNaOH = = 0,05 mol
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 NaOH
Vdd = = 500 ml
Vậy thể tích nước phải thêm là:
= 500 – 200 = 300 ml

a.\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(V_{dd}=\dfrac{120}{1,2}=100ml=0,1l\)
\(C_{M_{NaOH}}=\dfrac{0,2}{0,1}=2M\)
b.\(n_{NaOH}=\dfrac{21,6}{40}=0,54mol\)
\(V_{dd}=\dfrac{180}{1,2}=150ml=0,15l\)
\(C_{M_{NaOH}}=\dfrac{0,54}{0,15}=3,6M\)

Đáp án A
Gọi số mol HCl và H2SO4 lần lượt là 2x và 3x mol
HCl + NaOH → NaCl + H2O
2x 2x mol
H2SO4+ 2NaOH→ Na2SO4+ 2H2O
3x 6x mol
nNaOH= 2x+6x=0,5.0,8 suy ra x= 0,05 mol
Do đó CM HCl= 2.0,05/0,1=1M; CMH2SO4= 3.0,05/0,1=1,5M

a) nNaOH=8/40=0,2 mol
=> CM=0,2/0,8=0,25 M
b) coi nước là đ NaOH 0M
SƯr dụng pp sơ đồ đường chéo 200ml NaOH 1 M 0.1-0=0,1
ddNaOH 0,1M
?m H2O 0M 1-0,1=0.9
=>số ml nước cần dùng =(200.0,9)/0,1=1800 ml H2O.