Hỗn hợp X gồm Fe và Cu, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\%m_{Fe}=100-43,24=56,76\%\\ X+HCl\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=\dfrac{14,8.56,76\%}{56}=0,15\left(mol\right)\\ Tacó:n_{H_2}=n_{Fe}=0,15\left(mol\right)\\ \Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\\ \Rightarrow ChọnD\)

Đáp án D
%Fe = 100% - 43,24% = 56,76%
Khối lượng của Fe là
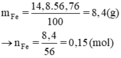
Fe + 2HCl → FeCl2 + H2
0,15(mol) 0,15(mol)
VH2 = 0,15 x 22,4 = 3,36 (lit)

Bài 5:
mCu= 43,24% . 14,8\(\approx\) 6,4(g)
=>mFe\(\approx\) 14,8 - 6,4= 8,4(g)
=> nFe\(\approx\) 8,4/56\(\approx\) 0,15(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
nH2=nFe \(\approx\) 0,15 (mol)
=> V(H2,đktc) \(\approx\) 0,15 . 22,4\(\approx\) 3,36(l)
Bài 6:
nH2= 4,368/22,4=0,195(mol)
Đặt: nMg=a(mol); nAl=b(mol) (a,b>0)
PTHH: Mg + 2 HCl -> MgCl2 + H2
a________2a_____a_____a(mol)
2 Al + 6 HCl -> 2 AlCl3 +3 H2
b____3b____b______1,5b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24a+27b=3,87\\a+1,5b=0,195\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,06\\b=0,09\end{matrix}\right.\)
a) nH2SO4= 2a+3b=0,39(mol)
=> mH2SO4= 0,39.98=38,22(g)
b) m(muối)= mMgSO4 + mAl2(SO4)3= 120a+ 133,5b= 120.0,06+133,5.0,09= 19,215(g)

Đáp án B
mFe = 14,8(100% - 43,24%) = 8,4g => nH2 = nFe = 0,15 => V = 3,36

Đáp án B
mFe = 14,8(100% - 43,24%) = 8,4g => nH2 = nFe = 0,15 => V = 3,36 => Chọn B.

Đáp án B
mFe = 14,8(100% - 43,24%) = 8,4g => nH2 = nFe = 0,15 => V = 3,36 =>> Chọn B.

(gam). => mFe =14,8 – 6,4 = 8,4 (gam).
Fe + 2HCl -> FeCl2 + H2
=> V = 0,15.22,4 = 3,36 (lít).
Chọn D.

(gam). => m =14,8 – 6,4 = 8,4 (gam).
\(Fe+2HCI->FeCl_2+H_2\)
=> V = 0,15.22,4 = 3,36 (lít)
chọn D
