Hỗn hợp khí X gồm hai kim loại K và Al có khối lượng 10,5 gam. Hòa tan hoàn toàn hỗn hợp X trong nước được dung dịch A. Thêm từ từ dung dịch HCl 1M vào dung dịch A: lúc đầu không có kết tủa, khi thêm được 100 ml dung dịch HCl 1M thì bắt đầu có kết tủa. Tính thành phần % số mol của các kim loại trong X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol K và Al trong hỗn hợp x, y
2K + 2H2O → KOH + H2 (1)
x x (mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y (mol)
Do x tan hết nên Al hết, KOH dư sau (2). Khi thêm HCl, ban đầu chưa có kết tủa vì:
HCl + KOH → KCl + H2O (3)
X – y x – y (mol)
Khi HCl trung hòa hết KOH dư thì bắt đầu có kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 ↓ + KCl (4)
Vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: nHCl = nKOH dư sau phản ứng (2) = x – y = 0,1.1 = 0,1 (mol) (I)
Mặt khác: 39x + 27 y = 10,5 (II)
Từ (1) và (II) ⇒ x = 0,2; y = 0,1.
% nK =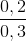 .100% = 66,67%;
.100% = 66,67%;
%nAl = 100% – 66,67% = 33,33%.

Ta có phương trình:
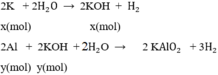
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
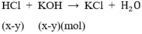
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Gọi x, y lần lượt là mol K và Al ban đầu
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
Theo pt ⇒ x - y = 0,1
Theo bài ra ta có hệ pt:
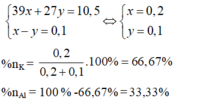

Khi hòa tan X vào nước ta có phản ứng:
K + H2O --> KOH + (1/2)H2 ↑ (1)
Al + KOH + H2O --> KAlO2 + (3/2)H2 ↑ (2)
x ---- x
- - -
dung dịch A thu được gồm KAlO2 và KOH còn dư
khi cho HCl vào A, thì phản ứng trung hòa xãy ra trước, các pứ như sau:
HCl + KOH --> KCl + H2O (3)
HCl + KAlO2 + H2O --> KCl + Al(OH)3 ↓ (4)
3HCl + Al(OH)3 --> AlCl3 + 3H2O (5)
theo đề bài phản ứng (1) xãy ra xong, vừa bắt đầu có ↓ nên HCl vừa đủ cho pứ (3)
=> số mol HCl cho pứ (3) là 0,1*1 = 0,1 mol = mol KOH trong A
Gọi x là số mol Al => mol KOH (pư2) = x
=> mol KOH tạo thành từ (1) = x + 0,1
(ta hiểu KOH tạo ra từ (1), một phần cho pứ với Al ở (2), phần còn lại pứ với HCl)
từ (1) => mol K = x + 0,1
ta có: mX = 27x + 39(x+0,1) = 10,5 => x = 0,1
=> mAl = 27*0,1 = 2,7
%Al = 2,7*100 /10,5 = 25,71 %
% K = 74,29 %

a) Đặt nK = a và nAl = b ta có:
39a + 27b = 10,5 (1)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
a............................a
\(Al+KOH+H_2O\rightarrow KAlO_2+\dfrac{3}{2}H_2\)
b...........b...............................b
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
\(HCl+KOH\rightarrow KCl+H_2O\)
(a-b)<-----(a-b)
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
a – b = nHCl = 0,1 (2)
Giải hệ (1) và (2) ta có: a = 0,2 và b = 0,1
=> \(\%m_K=\dfrac{0,2.39}{10,5}=74,29\%\); \(\%m_{Al}=25,71\%\)




Gọi số mol K và Al trong hỗn hợp x, y
2K + 2H2O → KOH + H2 (1)
x x (mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y (mol)
Do x tan hết nên Al hết, KOH dư sau (2). Khi thêm HCl, ban đầu chưa có kết tủa vì:
HCl + KOH → KCl + H2O (3)
X – y x – y (mol)
Khi HCl trung hòa hết KOH dư thì bắt đầu có kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 ↓ + KCl (4)
Vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: nHCl = nKOH dư sau phản ứng (2) = x – y = 0,1.1 = 0,1 (mol) (I)
Mặt khác: 39x + 27 y = 10,5 (II)
Từ (1) và (II) => x = 0,2; y = 0,1.
% nK =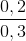 .100% = 66,67%;
.100% = 66,67%;
%nAl = 100% - 66,67% = 33,33%.
K + HOH --> KOH +1/2H2
Al + KOH + HOH --> KAlO2 +3/2H2
-Cho HCl vào bd kg có ket tua => KOH du
HCl + KOH --> KCl + HOH
-Sau đó có ket tua => KOH het => KAlO2 phan ung
KAlO2 + HCl + HOH --> Al(OH)3 + KCl
vì den 100ml dd HCl 1M co xuat hien ket tua nen => n(KAlO2) =n(HCl) = 0,1
=> n(Al) = 0,1
=> %Al = 25,71%
=> %K =74,29%
Luu y: hoi hóa xem bai giai co dung hay co van de nao kg gop ý dum nha thanks