Viết phương trình hóa học của các phản ứng hoàn thành dãy chuyển hóa sau:
a) Etan etilen
politilen.
b) Metan axetilen
vinylaxetilen
butanđien
polibutađien.
c) Benzen → brombenzen.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) (1) C2H6 C2H4 + H2
(2) nCH2 = CH2 ![]()
b) (1) 2CH4 C2H2 + 3H2
(2) 2CH ≡ CH CH2 = CH – C ≡ CH
(3) CH2 = CH – C ≡ CH + H2 CH2 = CH – CH = CH2
(4) nCH2 = CH – CH – CH2 ![]()
c) ![]() + Br
+ Br
![]() + HBr.
+ HBr.
a) (1) C2H6 => C2H4 + H2
(2) nCH2 => CH2- (-CH2-CH2-)n
b) (1) 2CH4 => C2H2 + 3H2
(2) 2CH ≡ CH => CH2 = CH – C ≡ CH
(3) CH2 = CH – C ≡ CH + H2 => CH2 = CH – CH = CH2
(4) nCH2 = CH – CH – CH2 => (-CH2-CH=CH-CH2)
c) C6H6 + Br =>C6H5Br + HBr.

Sơ đồ phản ứng:
CH4 C2H2
C2H4
C2H2 ![]() C6H6
C6H6 C6H5Cl
C6H6 ![]() C6H5NO2.
C6H5NO2.

\(nCH_2=CH_2\rightarrow\left(-CH_2-CH_2-\right)_n\)
\(CH_4\underrightarrow{^{H2,1400oC}}C_2H_2\rightarrow H_2C=CH-C\equiv CH\underrightarrow{^{+H2}}H_2C=\)
\(CH-CH=CH_2\underrightarrow{^{to,xt}}-\left(-CH_2-CH=CH-CH_2-\right)_n-\)

a)
\(4Al+3C\xrightarrow[]{1500-1700^oC}Al_4C_3\\ Al_4C_3+12H_2O\rightarrow4Al\left(OH\right)_3\downarrow+3CH_4\uparrow\\ CH_4+Cl_2\xrightarrow[]{a/s}CH_3Cl+HCl\\ CH_3Cl+Cl_2\xrightarrow[]{a/s}CH_2Cl_2+HCl\\ CH_2Cl_2+Cl_2\xrightarrow[]{a/s}CHCl_3\\ CHCl_3+Cl_2\xrightarrow[]{a/s}CCl_4+HCl\)
b)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\\ CH_3COONa+NaOH\xrightarrow[]{CaO,t^o}CH_4\uparrow+Na_2CO_3\)
\(CH_4+Cl_2\xrightarrow[]{a/s}CH_3Cl+HCl\\ 2CH_3Cl+2Na\xrightarrow[]{t^o}2NaCl+C_2H_6\\ C_2H_6\xrightarrow[]{t^o,xt}C_2H_4\)
c)
\(C_4H_{10}\xrightarrow[]{crackinh}C_2H_6+C_2H_4\\ C_2H_6+Cl_2\xrightarrow[]{a/s}C_2H_5Cl+HCl\\ 2C_2H_5Cl+2Na\xrightarrow[]{t^o,xt}C_4H_{10}+2NaCl\\ C_4H_{10}\xrightarrow[]{crackinh}CH_4+C_3H_6\\ C_3H_6+H_2\xrightarrow[]{Ni,t^o}C_3H_8\)

$C_4H_9OH\rightarrow C_4H_8+H_2O$ (điều kiện: $H_2SO_4$ đặc, 180 độ C)
$C_4H_8+H_2\rightarrow C_4H_{10}$ (điều kiện: Ni, nhiệt độ)
$C_4H_10\rightarrow CH_4+C_3H_6$ (điều kiện: cracking)
$CH_4\rightarrow C_2H_2+H_2$ (điều kiện: 1500 độ, làm lạnh nhanh)
$C_2H_2+H_2\rightarrow C_2H_4$ (điều kiện: Pb/PdCO3)
$C_2H_4+KMnO_4+H_2O\rightarrow C_2H_4(OH)_2+MnO_2+KOH$
$C_2H_4(OH)_2+HBr\rightarrow C_2H_4Br_2+H_2O$
$C_2H_4Br_2+Zn\rightarrow C_2H_4+ZnBr_2$

$C_4H_9OH\rightarrow C_4H_8+H_2O$ (điều kiện: $H_2SO_4$ đặc, 180 độ C)
$C_4H_8+H_2\rightarrow C_4H_{10}$ (điều kiện: Ni, nhiệt độ)
$C_4H_{10}\rightarrow CH-4+C_3H_6 (điều kiện: cracking)
$CH_4\rightarrow C_2H_2+H_2$ (điều kiện: Pb/PdCO_3)
$C_2H_4+KMnO_4+H_2O\rightarrow $C_2H_4(OH)_2+MnO_2+KOH$
$C_2H_4(OH)_2+HBr\rightarrow C_2H_4Br_2+H_2O$
$C_2H_4Br_2+Zn\rightarrow C_2H_4+ZnBr_2$
Viết phương trình hóa học của các phản ứng hoàn thành dãy chuyển hóa sau: Cl2 HCl ZnCl2 Zn(OH)2ZnCl2

H2 + Cl2 -> (ánh sáng) 2HCl
Zn + 2HCl -> ZnCl2 + H2
ZnCl2 + 2NaOH -> Zn(OH)2 + 2NaCl
Zn(OH)2 + 2HCl -> ZnCl2 + 2H2O
\(Cl_2+H_2\rightarrow2HCl\)
\(2HCl+Zn\rightarrow ZnCl_2+H_2\)
\(ZnCl_2+2OH\rightarrow Cl_2+Zn\left(OH\right)_2\)
\(Zn\left(OH\right)_2+2HCl\rightarrow2H_2O+ZnCl_2\)
a) (1) C2H6 \(\underrightarrow{t^o,xt}\) C2H4 + H2
(2) nCH2 = CH2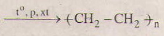
b) (1) 2CH4 \(\underrightarrow{1500^oC}\) C2H2 + 3H2
(2) 2CH ≡ CH \(\underrightarrow{t^o,xt}\) CH2 = CH – C ≡ CH
(3) CH2 = CH – C ≡ CH + H2 \(\xrightarrow[t^o]{Pd\text{/}PbCO_3}\) CH2 = CH – CH = CH2
(4) nCH2 = CH – CH – CH2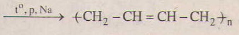
c)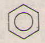 + Br
+ Br 
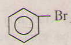 + HBr.
+ HBr.