hòa tan hoàn toàn 9,1g hỗn hợp Al và cu vào h2so4 đặc nóng thì thu được 5,6l khí so2(đktc)
- tính % khối lượng của mỗi kim loại trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

\(n_{SO_2}=\dfrac{13,644}{22,4}=0,61\left(mol\right)\)
Đặt n Fe = x (mol) =>\(m_{Fe}=56x\)
Vì m Fe = mMg => \(n_{Mg}=\dfrac{56x}{24}=\dfrac{7}{3}x\)
nAl = y(mol)
=> 56x + 56x + 27y = 16,14 (1)
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
Bảo toàn e : 3x + \(\dfrac{7}{3}.2x\) + 3y = 0,61.2 (2)
Từ (1), (2) => x=0,12 ; y=0,1
=> mFe =mMg=0,12.56 = 6,72(g)
m Al = 0,1.27=2,7(g)

Gọi $n_{Fe} = a ; n_{Mg} = b; n_{Al} = c$
Ta có :
$24b = 56a(1)$
$56a + 24b + 27c = 16,14(2)$
$n_{SO_2} = 0,61(mol)$
Bảo toàn electron : $3n_{Fe} + 2n_{Mg} + 3n_{Al} = 2n_{SO_2}$
$\Rightarrow 3a + 2b + 3c = 0,61.2(3)$
Từ (1)(2)(3) suy ra a = 0,12 ; b = 0,28 ; c = 0,1
$m_{Fe} = m_{Mg} = 0,12.56 = 6,72(gam)$
$m_{Al} = 0,1.27 = 2,7(gam)$

\(n_{SO_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PTHH: \(2Al+6H_2SO_4\underrightarrow{t^o}Al_2\left(SO_4\right)_3+3SO_2+6H_2O\\ Mg+2H_2SO_4\underrightarrow{t^o}MgSO_4+SO_2+2H_2O\)
Đặt \(n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\)
Ta có \(\left\{{}\begin{matrix}27a+24b=7,65\\1,5a+b=0,375\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{27.0,15}{7,65}.100\%=52,94\%\\ \%m_{Mg}=100\%-52,94\%=47,06\%\)

2Al+6HCl->2AlCL3+3H2(1)
Mg+2HCL->MgCL2+H2(2)
Cu+2H2SO4(đặc)->CuSO4+SO2+2H2O(3)
(3)=>nCu=nSO2=2,24/22,4=0,1mol
=>mCu=0,1.64=6,4g ???? lớn hơn m hỗn hợp đề chắc sai

a) nFe = x mol ; nCu = y mol
Ta có: nSO2 = 0,4 mol
e cho: Fe0 - 3e → Fe3+
x mol → 3x mol → x mol
Cu0 - 2e → Cu2+
y mol → 2y mol → y mol
e nhận: S6+ + 2e → S4+
0,4 mol → 0,8 mol → 0,4 mol
- Theo định luật bảo toàn electron, ta có: tổng số mol e cho = tổng số mol e nhận
→ 3x + 2y = 0,8 (1)
- Khối lượng hỗn hợp ban đầu: mFe + mCu = 18,4 (g)
→ 56x + 64y = 18,4 (2)
Giải hệ hai phương trình (1) và (2), ta được: x = 0,18 mol ; y = 0,13 mol
mFe = 0,18 x 56 = 10,08 (g) → %mFe = 54,78% → %mCu = 100% - %mFe = 45,22%
b) Theo định luật bảo toàn electron, ta có: tổng số mol e cho = tổng số mol e nhận
→ ne nhận= 3x + 2y = 0,8
2H+ + 2e → H2
0,8 mol → 0,4 mol
VH2= 8,96 (l)

Đáp án B
Đặt nCu = x(mol); nZn=y(mol)
=> 64x + 65y = 12,9
Bảo toàn electron ta lại có: ne nhường = ne nhận
=> 2 . n Cu + 2 . n Zn = 2 n SO 2 + 6 n S
=> 2x + 2y = 0,4 => x = y = 0,1 (mol)
Vậy phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
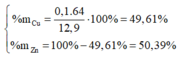
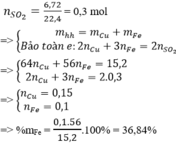
n SO2 = 0,25 mol
QT oxi hóa QT khử Al(0) -----> Al(+3) + 3e S(+6) + 2e --------> S(+4)mol x -----> 3x mol 0,5 <--------- 0,25 Cu(0) -------> Cu(+2) + 2emol y --------> 2y Theo bảo toàn e n (e nhường) = n (e nhận) <--> 3x + 2y = 0,5 (1)bảo toàn khối lượng 27x + 64y = 9,1 (2)Từ (1) và (2) ta có hpt\(\begin{cases}2x+3y=0,5\\27x+64y=9,1\end{cases}\)\(\Rightarrow\begin{cases}x=0,1\\y=0,1\end{cases}\)---> m al = 0,1*27=2,7 gam ---> %m al = (2,7 : 9,1)*100=29,6%----> %m cu = 100 - 29,6=70,4%