Để điều chế Fe người ta dùng 16g Fe2O3 tác dụng hết vs H2 ở nhiệt độ cao. Sắt mới thu đc cho phản ứng vs dung dịch H2SO4 loãng dư. Sau cùng thu đc 3l H2(đktc). Tính hiệu suất của phản ứng tạo sắt.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Zn+2H2SO4->ZnSO4+H2
0,2----------------------------0,2
n Zn=\(\dfrac{13}{65}\)=0,2 mol
=>VH2=0,2.22,4=4,48l
b)
Fe+2HCl->FeCl2+H2
0,1--------------0,05 mol
=>VH2=0,05.22,4=1,12l
\(a,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b,Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{HCl}=0,1\left(mol\right)\Rightarrow n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\)

a)\(n_{Al}=\dfrac{18}{27}=\dfrac{2}{3}mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}\) 1
\(V_{H_2}=1\cdot22,4=22,4l\)
b)\(n_{Fe_2O_3}=\dfrac{32}{160}=0,2mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,2 1 0,4 0,6
\(m_{Fe}=0,4\cdot56=22,4g\)
c)\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,4 \(\dfrac{4}{15}\)
\(V_{O_2}=\dfrac{4}{16}\cdot22,4=\dfrac{448}{75}l\)
\(V_{kk}=5V_{O_2}=\dfrac{448}{15}l\approx29,87l\)

`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,25` `0,25` `0,25` `(mol)`
`a)n_[Fe]=[22,4]/56=0,4(mol)`
`n_[H_2 SO_4]=[24,5]/98=0,25(mol)`
Có: `[0,4]/1 > [0,25]/1=>Fe` hết, `H_2 SO_4`
`=>m_[Fe(dư)]=(0,4-0,25).56=8,4(g)`
`b)V_[H_2]=0,25.22,4=5,6(l)`
Ko được ghi `Fe+H_2 SO_4->Fe_2 (SO_4)_3+H_2` vì đây là `H_2 SO_4` loãng

Đáp án B
nAl = 10,8: 27 = 0,4 mol ; nFe3O4 = 34,8: 232 = 0,15 mol
Ta thấy: 0,4/8 = 0,15/3 nên hiệu suất có thể tính theo Al hoặc Fe3O4
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Mol x → 1,125x => nAl dư = (0,4 –x) mol
Khi chất rắn sau phản ứng + HCl thì:
Al + 3HCl → AlCl3 + 1,5H2
Mol (0,4 – x) → 1,5(0,4 – x)
Fe + 2HCl → FeCl2 + H2
Mol 1,125x → 1,125x
=> nH2 = 1,5(0,4 – x) + 1,125x = 10,416: 22,4 = 0,465 mol
=> x = 0,36 mol
Tính H theo Al => H% = nPứ / nbđ = 0,36: 0,4 = 90%

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)=n_{Fe}\)
\(\Rightarrow n_{Fe_2O_3}=0,15\left(mol\right)\) \(\Rightarrow m_{Fe_2O_3}=x=0,15\cdot160=24\left(g\right)\)

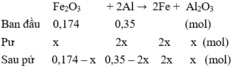

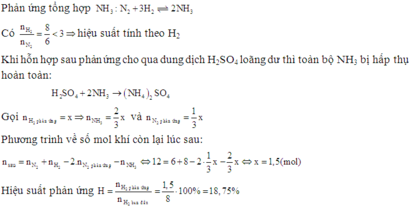
Mol \(Fe_2O_3\) bđ=16/160=0,1 mol
Mol \(H_2\) =3/22,4 mol\(Fe_2O_3\) +3\(H_2\) \(\rightarrow\)2\(Fe\) +3\(H_2O\)Bđ: 0,1 molPứ: 15/224 mol<=45/112 mol 3/22,4 molDư: 0,033 mol\(Fe\) + 2\(HCl\) \(\rightarrow\) \(FeCl_2+H_2\)3/22,4 mol<= 3/22,4 molLập tỉ lệ mol \(Fe_2O_3\) và \(H_2\) lần lượt với hệ số trong pt=> tính H% theo \(Fe_2O_3\)H%=(15/224)/0,1 .100%=66,96%