Hòa tan hoàn hoàn toàn 8,4g kl M trong dd h2so4 đặc, nóng vùa đủ cho ra một muối sunfat, nước và 5,04l so2 ở đktc. Xác định M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CO2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : \(MCO_3+H_2SO_4\rightarrow MgSO_4+CO_2+H_2O|\)
1 1 1 1 1
0,1 0,1 0,1 0,1
\(n_{MCO3}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Có : \(0,1.\left(M=60\right)=8,4\)
\(\left(M+60\right)=84\)
\(M=84-60=24\left(dvc\right)\)
Vậy kim loại M là magie
\(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{H2SO4}=0,1.98=9,8\left(g\right)\)
\(m_{ddH2SO4}=\dfrac{9,8.100}{12,25}=80\left(g\right)\)
\(n_{MgSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{MgSO4}=0,1.120=12\left(g\right)\)
\(m_{ddspu}=8,4+80=88,4\left(g\right)\)
\(C_{MgSO4}=\dfrac{12.100}{88,4}=13,57\)0/0
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn bố sung số mol của MgSO4 lên phương trình giúp mình và sửa giúp mình :
Pt : \(MCO_3+H_2SO_4\rightarrow MSO_4+CO_2+H_2O|\)

Coi oxit sắt là Fe và O có số mol lần lượt là x và y (mol)
nSO2 = 0,145 (mol)
Qúa trình nhường e
Fe -3e → Fe3+
x 3x (mol)
Quá trình nhận e
O + 2e → O-2
y 2y (mol)
S +6 +2e → SO2
0,29 ← 0,145 (mol)
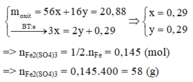
Đáp án A

M + 2H2SO4 => MSO4 + SO2 + 2H20
nSO2 = 1.68/22.4 = 0.075 MOL
=> nKIM LOẠI M = 0.075 mol
M của Kl M = m/n = 4.8/0.075 = 64 => Cu




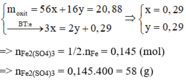

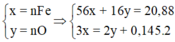
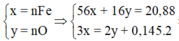
2M + 2nH2SO4 ---> M2(SO4)n + nSO2 + 2nH2O
Số mol SO2 = 5,04/22,4 = 0.225 mol.
Số mol M = 0,45/n mol.
M = 8,4:0,45/n = 18n
Chọn được giá trị phù hợp n = 3 và M = 56 (Fe).
A là đúng