Hỗn hợp X gồm Mg(NO3)2, Mg(OH)2, MgCO3 có tỉ lệ mol =1:2:3. Nhiệt phân hoàn toàn m gam X thu được m-22,08 gam MgO. Hòa tan toàn bộ lượng MgO sinh ra trong dung dịch hỗn hợp HCl 7,3% và H2SO4 9,8% vừa đủ thu được dung dịch Y. Cô cạn Y thu được bao nhiêu gam chất rắn khan?
A: 59,7 gam
B: 50,2 gam
C: 61,1 gam
D: 51,6 gam


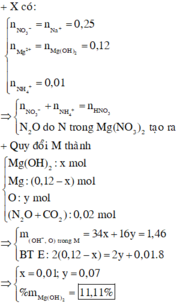
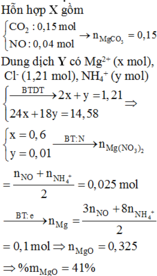
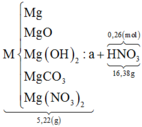
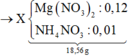
TL:
Mg(NO3)2 ---> MgO + 2NO2 + 1/2O2
x x 2x x/2
Mg(OH)2 ---> MgO + H2O
2x 2x 2x
MgCO3 ---> MgO + CO2
3x 3x 3x
Theo định luật bảo toàn khối lượng ta có: tổng khối lượng của (NO2 + O2 + CO2 + H2O) = 22,08 hay 46.2x + 16x + 44.3x + 18.2x = 22,08. Tính ra x = 0,08 mol.
Như vậy tổng số mol MgO = 6x = 0,48 mol.
MgO + 2HCl ---> MgCl2 + H2O
MgO + H2SO4 ---> MgSO4 + H2O
Gọi a là khối lượng của muối thu được sau phản ứng. Ta có khối lượng dung dịch của (HCl + HSO4) = a + m(H2O - m(MgO) = a + 18.0,48 - 40.0,48 = a - 10,56.
Số mol HCl = 0,073.(a-10,56)/36,5 = u; số mol H2SO4 = 0,098.(a-10,56)/98 =v.
Mà u/2 + v = 0,48 nên a = 247,227 g.