Cho 1,344 lít khí CO (đktc) đi qua ống sứ đựng 1,6 gam oxit sắt. Sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp khí có tỉ khối hơi so với He bằng 9. Xác định công thức của oxit sắt.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
![]()
n O t r o n g a x i t p h ả n ứ n g = n C O p h ả n ứ n g = n C O 2 sin h r a => tổng số mol khí trước và sau phản ứng là không đổi.
Hỗn hợp khí sau khi phản ứng là CO2 và CO dư
![]()
![]()
n O t r o n g o x i t p h ả n ứ n g = 0 , 75 . 0 , 24 = 0 , 18
n F e = (10,44 - 0,18.16)/56 = 0,135 mol
Gọi công thức của oxit là F e x O y
Ta có: x:y = 0,135:0,18 = 3:4 => Công thức của oxit là Fe3O4

Đáp án D
MxOy + yCO ——> xM + yCO2
![]()
=> Tổng số mol khí trước và sau phản ứng là không đổi.
Hỗn hợp khí sau phản ứng là CO2 và CO dư
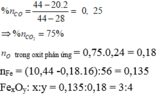
Trong hỗn hợp khí, Gọi $n_{CO} = a(mol) ; n_{CO_2} = b(mol)$
Ta có :
$a + b = \dfrac{1,344}{22,4} = 0,06(mol)$
$28a + 44b = (a + b)9.4$
Suy ra a = b = 0,03
$CO + O_{oxit} \to CO_2$
$n_O = n_{CO_2} = 0,03(mol)$
$\Rightarrow n_{Fe} = \dfrac{1,6 - 0,03.16}{56} = 0,02(mol)$
$n_{Fe} : n_O = 0,02 : 0,03 = 2 : 3$
Vậy oxit là $Fe_2O_3$
Khí thu được gồm CO dư và CO2.
PT: \(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2\)
Ta có: \(n_{CO\left(banđau\right)}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{CO\left(dư\right)}=a\left(mol\right)\\n_{CO_2}=b\left(mol\right)\end{matrix}\right.\)
⇒ a + b = 0,06 (1)
Mà: Tỉ khối hhk so với He bằng 9
⇒ 28a + 44b = 9.4.0,06 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,03\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
⇒ nCO (pư) = 0,03 (mol)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}n_{CO}=\dfrac{0,03}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{1,6}{\dfrac{0,03}{y}}=\dfrac{160}{3}y\left(g/mol\right)\)
\(\Rightarrow56x+16y=\dfrac{160}{3}y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: Oxit đó là Fe2O3.
Bạn tham khảo nhé!