Cho kim loại M có hóa trị (II). Hòa tan hết 8 gam oxit của M vào dung dịch axit clohiđric. Sau khi kết thúc phản ứng thấy có 0,4 mol HCl đã phản ứng. Kim loại M là ?
Em cần gấp ạ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho kim loại M có hóa trị (III). Cho 10,2 gam oxit của M vào dung dịch axit clohiđric. Sau khi kết thúc phản ứng thấy có 0,6 mol HCl đã phản ứng. Kim loại M là
A. Fe
B. Mg
C. Cu
D. Al
\(M_2O_3+6HCl\rightarrow2MCl_3+3H_2O\)
\(n_{oxit}=\dfrac{1}{6}n_{HCl}=0,1\left(mol\right)\)
Ta có : \(M_{oxit}=2M+16.3=\dfrac{10,2}{0,1}=102\)
=> M=27 (Al)

Đáp án A
Phương trình hóa học: M O + 2 H C l → M C l 2 + H 2 O
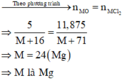

a) \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,5}{n}\left(mol\right)\)
Ta có : \(M_M=\dfrac{16,25}{\dfrac{0,5}{n}}=32,5n\)
Chạy nghiệm n
n=1 => M=32,5 (loại)
n=2 => M=65 ( chọn)
n=3 => M=97,5 (loại)
Vậy M là Zn
b) Ta có : \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(lít\right)\)

Gọi công thức hóa học của oxit là RO
→Phương trình hóa học: RO+2HCl→RCl2+H2O
nRO:8,1\(R+16nRO)= nRCl2: 13,6\R+35,5.2
⇔ 8,1.(R+71)=13,6.(R+16)
⇔ 8,1R+575,1=13,6R+217,6
⇔ 8,1R−13,6R=−575,1+217,6
⇔ −5,5R=−357,5
⇔ R=65 (Zn)
→ R là nguyên tố Kẽm (Zn)
công thức hóa học: ZnO

nHCl = 0,35 . 1 = 0,35 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,175 0,35 0,175 0,175 (mol)
nHCl (pứ 2 ) = 0,2 . 2 = 0,4 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,2 0,4
\(nX=0,175+0,2=0,375\left(mol\right)\)
=> \(MX=\dfrac{11,7}{0,375}=\) 31,2 .-. k ra là s

\(a/\\ M+2nHCl \to MCl_n+nH_2\\ n_{H_2}=\frac{5,6}{22,4}=0,25(mol)\\ n_M=\frac{1}{n}.n_{H_2}=\frac{1}{n}.0,25=\frac{0,25}{n}(mol)\\ M_M=\frac{16,25.n}{0,25}=65.n(g/mol)\\ \text{Chạy biện luân:}\\ \Rightarrow n=1; R=65(Zn)\\ b/\\ Zn+2HCl\to ZnCl_2+H_2\\ n_{HCl}=2.n_{H_2}=2.0,25=0,5(mol)\\ V_{HCl}=\frac{0,5}{0,2}=2,5M \)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : M + 2HCl → MCl2 + H2\(|\)
1 2 1 1
0,25 0,25
a) Số mol của kim loại M
nM = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
⇒ MM = \(\dfrac{m_M}{n_M}=\dfrac{16,25}{0,25}=65\) (dvc)
Vậy kim loại M là Zn
b) Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,25 0,5
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Thể tích của dung dịch axit clohdric cần dùng
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)
Chúc bạn học tốt

Xin lỗi mấy bạn nha mình ghi lộn A B là hai kim loại có cùng hóa trị II

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)
`MO + 2HCl -> MCl_2 + H_2O`
Theo PT: `n_(MO) = (n_(HCl))/2`
`<=> 8/(M_M +16) = (0,4)/2`
`<=> M_M = 24`
`=>M` là `Mg`.
\(MO+2HCl\rightarrow MCl_2+H_2O\)
Ta có : \(n_{MO}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\)
=> \(M_{MO}=\dfrac{8}{0,2}=40\)
=> M=24 (Mg)