Hoà tan hết kim loại kiềm M trong 500ml dung dịch HCl 1M thu được 42,85 gam chất tan và V lít H2 (đktc). Xác định kim loai M và tính giá trị của V.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(M+H_2O\rightarrow MOH+\dfrac{1}{2}H_2\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Ta có: \(n_M=2n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{4,6}{0,2}=23\left(Na\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,2......................0,2..........0,1
TH1: HCl dư sau phản ứng
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,2..............0,2..............0,2
\(m_{NaCl}=0,2.58,5=11,7\) (g) > m chất tan
=> Loại
TH2: NaOH dư
Gọi x là số mol HCl phản ứng
\(NaOH+HCl\rightarrow NaCl+H_2O\)
x.................x.............x
Ta có : \(m_{ct}=\left(0,2-x\right).40+x.58,8=10,96\)
=> x = 0,16
=> \(V=\dfrac{0,16}{1}=0,16\left(l\right)\)

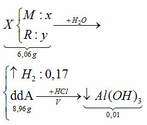
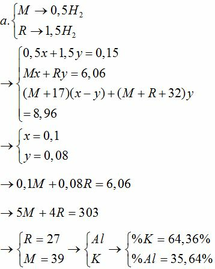
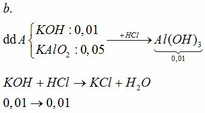
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

Thể tích dung dịch HCl dùng cho cả 2 phản ứng bằng nhau, nên có cùng số mol. Kí hiệu X, Y là khối lượng mol nguyên tử của 2 kim loại.
Phương trình hoá học của phản ứng :
2X + 2nHCl → 2X Cl n + n H 2 ↑
n H 2 = 0,672 /22,4 = 0,03 mol
Theo đề bài: 0,06/n x X = 1,95 → X = 32,5n
Kẻ bảng
| n | 1 | 2 | 3 |
| X | 32,5 | 65 | 97,5 |
Vậy X là Zn
Y 2 O m + mHCl → Y Cl m + m H 2 O
Theo đề bài, ta có:
(2Y + 16m) = 1,6 → Y = 56/3.m
Kẻ bảng
| m | 1 | 2 | 3 |
| Y | 56,3 | 112/3 | 56 |
Vậy Y là Fe.

a, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(M+H_2SO_4\rightarrow MSO_4+H_2\)
Theo PT: \(n_M=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{11,2}{0,2}=56\left(g/mol\right)\)
→ M là Fe.
b, Theo PT: \(n_{FeSO_4}=n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,2\left(mol\right)\)
⇒ nH2SO4 dư = 0,5.1 - 0,2 = 0,3 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,3}{0,5}=0,6\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\end{matrix}\right.\)
c, Ta có: \(n_{FeSO_4.7H_2O}=n_{FeSO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{FeSO_4.7H_2O}=0,2.278=55,6\left(g\right)\)
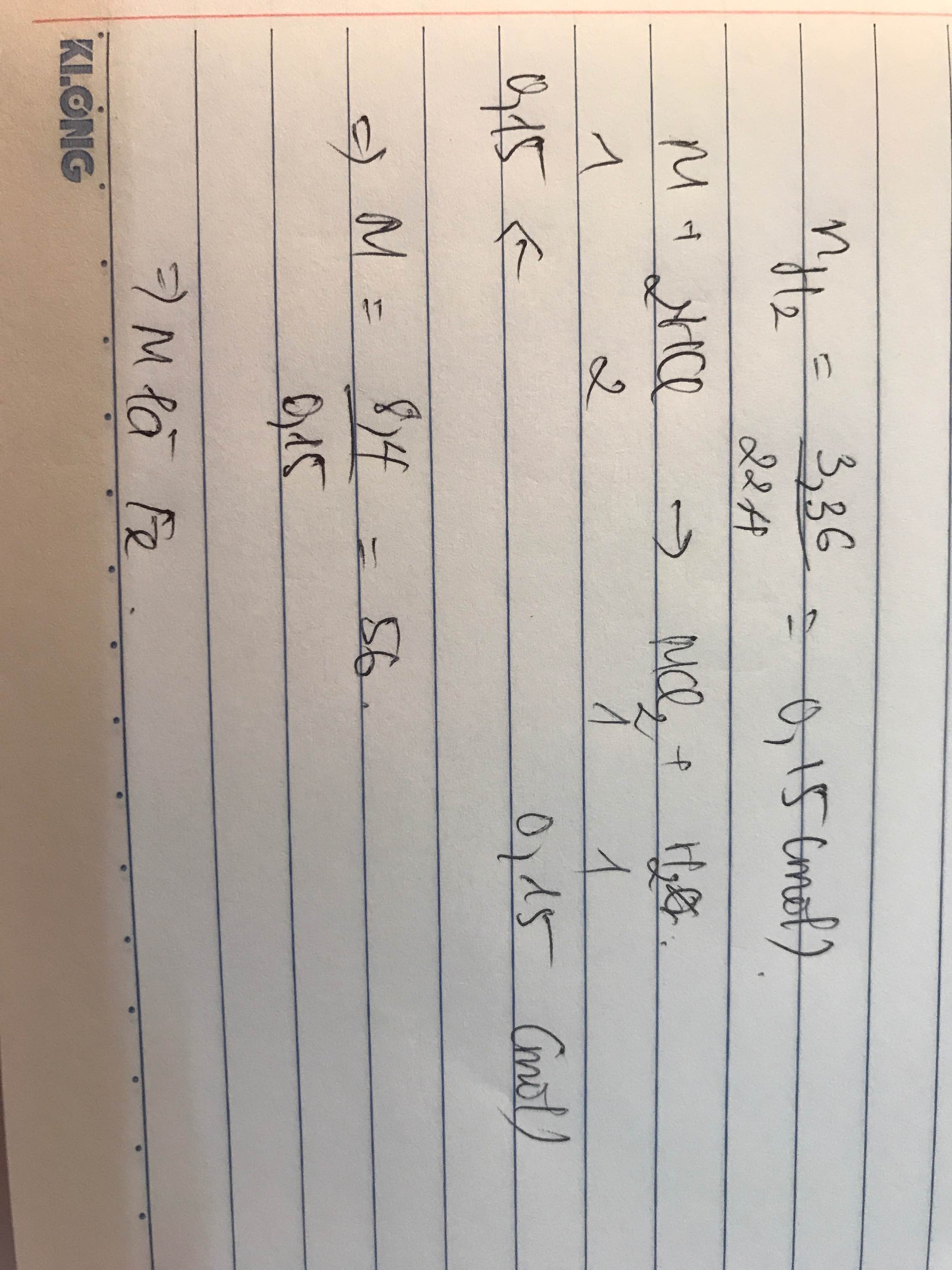



Đề có nhầm ở đâu không nhỉ ?