Đốt cháy hoàn toàn 2,24 lít hỗn hợp các este no , đơn chức mạch hở . Sản phẩm cháy đc dẫn quá bình đựng dd Ca (OH)2 lấy dư thấy khối lượng bình tăng thêm 18,6g ( các sp cháy đã bị hấp thụ hoàn toàn vào bình). Khối lượng este đã bị đốt cháy?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giải thích:
Gọi CT của axit no, đơn chức, mạch hở là CnH2nO2
Đốt cháy CnH2nO2 luôn cho nCO2 = nH2O
Gọi nCO2 = nH2O = x ( mol)
=> mtăng = mCO2 + mH2O
=> 44x + 18x = 18,6
=> x = 0,3 (mol)
BTNT C: nCaCO3 = nCO2 = 0,3 (mol) => mCaCO3 = 0,3.100 = 30 (g)
Đáp án A

Chọn đáp án A
► Este no, đơn chức, mạch hở có dạng CnH2nO2 ⇒ đ ố t c h o n C O 2 = n H 2 O = x
⇒ m b ì n h t ă n g = m C O 2 + m H 2 O = 44 x + 18 x = 24 , 8 ( g ) ⇒ x = 0,4 mol.
⇒ n C a C O 3 = n C O 2 = 0 , 4 m o l
⇒ m = 0,4 × 100 = 40(g)

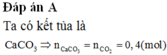
Ta có khối lượng bình tăng chính là tổng khối lượng của CO2 và H2O:
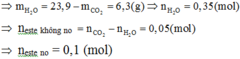
Gọi n và m lần lượt là số cacbon của este no và không no.
Ta có:


Đáp án C
n e s t e = 4 , 4 88 = 0 , 05 ⇒ n C O 2 = n H 2 O = 0 , 05 . 4 = 0 , 2
⇒ n O 2 = 0 , 2 . 44 + 0 , 2 . 18 - 4 . 4 32 = 0 , 25
⇒ V = 5 , 6
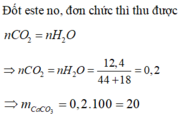
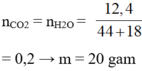
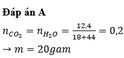
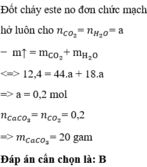
$n_{CO_2} = n_{H_2O} = a(mol)$
Ta có :
$m_{tăng} = m_{CO_2} + m_{H_2O} = 44a + 18a = 18,6(gam)$
$\Rightarrow a = 0,3$
$n_{este} = 0,1(mol)$
CTHH este : $C_nH_{2n}O_2$
Ta có :
$n = n_{CO_2} : n_{este} = 0,3 : 0,1 = 3$
Suy ra: este là $C_3H_6O_2$
$m_{este} = 0,1.74 = 7,4(gam)$