Một hỗn hợp chứa Fe, FeO, Fe2O3. Nếu hoà tan a gam hỗn hợp trên bằng dung dịch HCI dư thì khối lượng H2 thoát ra bằng 1,00% khối lượng hỗn hợp đem thí nghiệm. Nếu khử a gam hỗn hợp trên bằng H2 dư thì thu được khối lượng nước bằng 21,15% lượng hỗn hợp đem thí nghiệm. Xác định phần trăm về khối lượng mỗi chất có trong a gam hỗn hợp trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử a=100(g)
Fe2O3+6HCl→2FeCl2+h2o
Gọi a,b lần lượt là số mol của FeO, Fe2O3 (a,b > 0 )
%mFe=28%
%mFeO=0,5.72=36%
%mFe2O3=36%.

\(m_{H_2}=0,01a\left(g\right)\)
=> \(n_{H_2}=\dfrac{0,01a}{2}=0,005a\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,005a<----------------0,005a
=> mFe = 56.0,005a = 0,28a (g)
Gọi số mol FeO, Fe2O3 là x, y (mol)
=> 72x + 160y = a - 0,28a = 0,72a (1)
\(m_{H_2O}=0,2115a\left(g\right)\)
=> \(n_{H_2O}=\dfrac{0,2115a}{18}=0,01175a\left(mol\right)\)
PTHH: FeO + H2 --to--> Fe + H2O
x---------------------->x
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
y----------------------------->3y
=> x + 3y = 0,01175a (2)
(1)(2) => \(\left\{{}\begin{matrix}x=0,005a\left(mol\right)\\y=0,00225a\left(mol\right)\end{matrix}\right.\)
=> \(\%Fe=\dfrac{0,28a}{a}.100\%=28\%\)
\(\%FeO=\dfrac{72.0,005a}{a}.100\%=36\%\)
\(\%Fe_2O_3=\dfrac{160.0,00225a}{a}.100\%=36\%\)
\(m_{H_2}=0,01a\left(g\right)\\ \Rightarrow n_{Fe}=n_{H_2}=0,005a\left(mol\right)\\\Rightarrow m_{FeO,Fe_2O_3}=a-0,005a.56=0,72a\\ Đặt:n_{FeO}=x\left(mol\right);n_{Fe_2O_3}=y\left(mol\right)\left(x,y>0\right)\\ \Rightarrow72x+160y=0,72a\left(1\right)\\ m_{H_2O}=0,2115a\\ \Leftrightarrow18x+54y=0,2115a\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\dfrac{504}{47}x=\dfrac{1120}{47}y\\ \Rightarrow\dfrac{x}{y}=\dfrac{\dfrac{1120}{47}}{\dfrac{504}{47}}=\dfrac{20}{9}\\ \Rightarrow\%m_{Fe}=\dfrac{0,28a}{a}.100=28\%\\Ta.có:x.72+0,45x.160=0,72a\\ \Leftrightarrow144x=0,72a\\ \Leftrightarrow\dfrac{x}{a}=\dfrac{0,72}{144}=0,005\\ \Rightarrow\%m_{FeO}=\dfrac{72.0,005a}{a}.100=36\%\)
\(\Rightarrow\%m_{Fe_2O_3}=100\%-\left(28\%+36\%\right)=36\%\)

Giả sử \(a=100\left(g\right)\)
\(\Rightarrow m_{H_2}=1\%.100=1\left(g\right)\Rightarrow n_{H_2}=0,5\left(mol\right)\)
\(Fe\left(0,5\right)+2HCl\rightarrow FeCl_2+H_2\left(0,5\right)\)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(\Rightarrow m_{FeO,Fe_2O_3}=100-0,5.56=100-28=72\left(g\right)\)
Gọi a,b lần lượt là số mol của FeO, Fe2O3 (a,b > 0 )
\(\Rightarrow72a+160b=72\left(I\right)\)
\(FeO\left(a\right)+H_2\rightarrow Fe+H_2O\left(a\right)\)
\(Fe_2O_3\left(b\right)+3H_2\rightarrow2Fe+3H_2O\left(3b\right)\)
\(m_{H_2O}=21,15\%.100=21,15\left(g\right)\)
\(\Rightarrow a+3b=\dfrac{21,15}{18}=1,175\left(II\right)\)
Từ (I) và (II) \(\Rightarrow a=0,5;b=0,225\)
\(\%m_{Fe}=28\%\)
\(\%m_{FeO}=0,5.72=36\%\)
\(\%m_{Fe_2O_3}=36\%.\)

mH2=0,01a(g)<=>5.10-3a(mol)
nH2=nFe=0,005a(mol)
\(\left\{{}\begin{matrix}72n_{FeO}+160n_{Fe_2O_3}=a-56.0,005a\\n_{FeO}+3n_{Fe_2O_3}=\frac{0,2115a}{18}\end{matrix}\right.\)
=>nFeO=0,005a;nFe2O3=0,00225a
=>phần trăm khối lượng mỗi chất
Giả sử a=100g
Gọi số mol Fe, FeO và Fe2O3 là a, b, c
->56a+72b+160c=100
mH2=1%.100=1g
->nH2=1/2=0,5mol
Ta có Fe+2HCl->FeCl2+H2
->nFe=nH2=0,5mol=a
mH2O=21,15%.100=21,15g
->nH2O=21,15/18=1,175mol
Ta có FeO+H2->Fe+H2O
Fe2O3+3H2->2Fe+3H2O
->b+3c=1,175
->a=0,5; b=0,5; c=0,225
->%mFe=0,5.56/100=28%
->%mFeO=0,5.72/100=36%
->%mFe2O3=36%

Câu 4 .
1)
SO3+H2O->H2SO4
mdd H2SO4=500x1,2=600g
nH2SO4=600x24,5%/98=1,5 mol
gọi a là số mol SO3
ta có
mdd spu=600+80a
nH2SO4=1,5+a
Ta có
(1,5+a)x98/(600+80a)=49%
=>a=2,5 mol
=>mSO3=2,5x80=200 g
2)
nSO3=200/80=2,5 mol
SO3+H2O\(\rightarrow\)H2SO4
mdd spu=m+200 (g)
nH2SO4=m.49%/98+2,5=0,005m+2,5
Ta có
(0,005m+2,5).98/(m+200)=78,4%
\(\rightarrow\)m=300 g
Câu 5
Giả sử a=100g
Gọi số mol Fe, FeO và Fe2O3 là a, b, c
\(\rightarrow\)56a+72b+160c=100
mH2=1%.100=1g
\(\rightarrow\)nH2=1/2=0,5mol
Ta có Fe+2HCl\(\rightarrow\)FeCl2+H2
\(\rightarrow\)nFe=nH2=0,5mol=a
mH2O=21,15%.100=21,15g
\(\rightarrow\)nH2O=\(\frac{21,15}{18}\)=1,175mol
Ta có FeO+H2\(\rightarrow\)Fe+H2O
Fe2O3+3H2\(\rightarrow\)2Fe+3H2O
\(\rightarrow\)b+3c=1,175
\(\rightarrow\)a=0,5; b=0,5; c=0,225
\(\rightarrow\)%mFe=\(\frac{\text{0,5.56}}{100}\)=28%
\(\rightarrow\)%mFeO=\(\frac{\text{0,5.72}}{100}\)=36%
\(\rightarrow\)%mFe2O3=36%

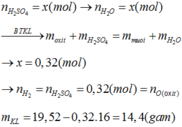
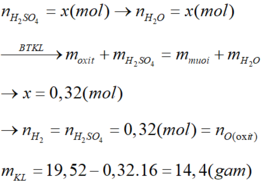
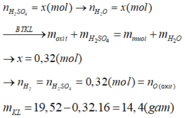
Giả sử khối lượng hỗn hợp a là 100g
Gọi số mol Fe, FeO và Fe2O3 lần lượt là x, y, z
->56x+72y+160z=100 (1)
Vì khối lượng H2 thoát ra bằng 1,00% khối lượng hỗn hợp đem thí nghiệm mH2=1%.100=1g
=> nH2=\(\dfrac{1}{2}\)=0,5mol
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT nFe = nH2 = 0,5mol =x (2)
Vì khử a gam hỗn hợp trên bằng H2 dư thì thu được khối lượng nước bằng 21,15% lượng hỗn hợp đem thí nghiệm.
=> mH2O=21,15%.100 = 21,15g
->nH2O=\(\dfrac{21,15}{18}\)=1,175mol
PTHH: \(FeO+H_2\rightarrow Fe+H_2O\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Ta có: \(n_{H_2O}=\) y+3z=1,175 (3)
Từ (1), (2), (3) =>x=0,5; y=0,5; z=0,225
->%mFe=\(\dfrac{0,5.56}{100}=28\%\)
->%mFeO=\(\dfrac{0,5.72}{100}=36\%\)
->%mFe2O3=100-28-36 = 36%