Cho m gam Ba tác dụng với H2O dư sau phản ứng thu được 500 ml dung dịch có CM = 0,05. Để trung hòa dung dịch thu được cần
dùng V ml dung dịch HCl 0,5M. Xác định giá trị của m và V . (m = 3,425g; V = 100ml)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
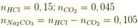
![]()
![]()
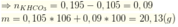
Khi cho từ từ X vào HCl thì tác dụng với HCl theo tỷ lệ số mol
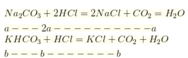
ta có: ![]()
![]()

Chọn D
nCu2+ = 0,5V, nMg2+ = 0,3V, nH2 = 0,03mol
KL tan được trong dd HCl => Cu2+ và Ag+ hết
=> Bảo toàn e
0,5V . 2 + 0,3V = 0,045.2 + 0,05.2 – 0,03.2 = 0,13
=> V = 0,1 lít

Ta có nNaOH = 0,006 mol ; nH2SO4 = 0,028 mol
=>nH2SO4 phản ứng X = 0,05 mol = nX
=>các amino axit trong X chỉ chứa 1 nhóm NH2.
+/ Xét ½ X có số mol 0,025 . nBa(OH)2 = 0,015 mol
=>Lượng OH- trung hòa ½ X là 0,03 mol > 0,025
=>Trong X có 1 amino axit có 1 nhóm COOH ; axit còn lại có 2 nhóm COOH
=> naa có 2 nhóm COOH = 0,005 mol ; naa có 1 nhóm COOH = 0,02 mol
Đặt CT 2 amino axit là R1(NH2)(COOH) ; R2(NH2)(COOH)2
=>Tạo muối với Ba(OH)2 và nH2O = nOH- = 0,03 mol
Bảo toàn Khối lượng : m1/2 X= 2,235g
=> 0,02.( R1 + 61) + 0,005.(R2 + 106) = 2,235
=> 4R1 + R2 = 97
=>R1 = 14 (CH2) và R2 = 41 ( C3H5) TM
=> Do MB > MA => B là NH2-C3H5-(COOH)2
=>%mM(X) = 32,89%
=>D

a, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: M + 2H2O → M(OH)2 + H2
Mol: 0,1 0,1 0,1
\(\Rightarrow M_M=\dfrac{4}{0,1}=40\left(g/mol\right)\)
⇒ M là canxi (Ca)
\(C\%_{ddCa\left(OH\right)_2}=\dfrac{0,1.74.100\%}{500}=1,48\%\)
b) \(m_{Ca\left(OH\right)_2}=200.1,48=2,96\left(g\right)\Rightarrow n_{Ca\left(OH\right)_2}=\dfrac{2,96}{74}=0,04\left(mol\right)\)
PTHH: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Mol: 0,04 0,08
\(V_{ddHCl}=\dfrac{0,08}{2}=0,04\left(l\right)=40\left(ml\right)\)


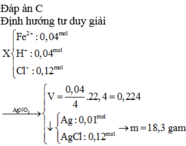
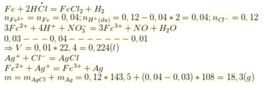
a)Ba+2H2O-->Ba(OH)2+H2
Ta có
n H2=3,36/22,4=0,15(mol)
Theo pthh
n H2=n Ba=0,15(mol)
m Ba=0,15.137=20,55(g)
b) Theo pthh
n Ba(OH)2=n H2=0,15(mol)
CM Ba(OH02=0,15/0,5=0,3(M)
c) Ba(OH)2+H2SO4-->BaSO4+2H2O
Ta có
n H2SO4=0,3.0,3=0,09(mol)
-->H2SO4 hết..Ba(OH)2 dư
Theo pthh
n BaSO4=n H2SO4=0,09(mol)
m BaSO4=0,09.233=20,97(g)