Điện phân 500ml dung dịch gồm CuCl2 0.1M; FeCl3 0.1M; HCl 0.1M rồi điện phân bằng điện cực trơ với cường độ dòng điện I=9,65A trong thời gian 41 phút 40 giây (hiệu suất quá trình là 100%) khối lượng các chất thoát ra ở catot và thể tích khí thoát ra ở anot (đktc) là A. 4,65g và 2,8 lít B. 5,45g và 2,24 lít C. 5,32g và 4,48 lít D. 4,56g và 11,2 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


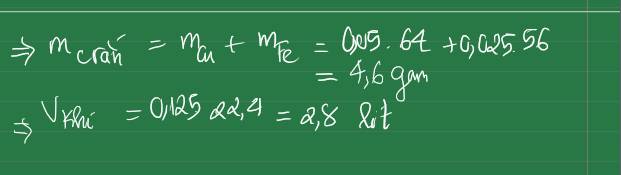

Chọn C
Catot :
Fe3+ + 1e -> Fe2+
Cu2+ + 2e -> Cu
Fe2+ + 2e -> Fe
Anot : 2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
,nFe3+ = 0,2 mol ; nCu2+ = 0,25 mol ; nCl = 1,1 mol
nkhí = 0,4 mol < ½ nCl ( Cl- dư) => ne = 0,4.2 = 0,8 mol
=> sau phản ứng có : 0,25 mol Cu và 0,05 mol Fe
=> mKL = 18,8g

\(Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\\ ZnO + 2HCl \to ZnCl_2 + H_2O\\ MgO + 2HCl \to MgCl_2 + H_2O\\ n_{HCl} = 0,5.0,1 = 0,05(mol)\\ n_{H_2O} = \dfrac{1}{2}n_{HCl} = 0,025(mol)\\ \text{Bảo toàn khối lượng : }\\ m_{muối} = m_{hỗn\ hợp} + m_{HCl} - m_{H_2O} = 1,405 + 0,05.36,5 - 0,025.18 = 2,78(gam)\)

Đáp án A
Tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+ > H2O (Fe2+ do Fe3+ bị điện phân sinh ra)
=> Thứ tự điện phân ở catot là: Fe3+ > Cu2+ > H+ > Fe2+ > H2O

Đáp án A
Tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+ > H2O (Fe2+ do Fe3+ bị điện phân sinh ra)
=> Thứ tự điện phân ở catot là: Fe3+ > Cu2+ > H+ > Fe2+ > H2O

HD:
CH3COOH \(\leftrightarrow\) CH3COO- + H+
Ban đầu: 0,1 M 0,1 M 0
Cân bằng: 0,1-x 0,1+x x
Hằng số cb: ka = [CH3CO-][H+]/[CH3COOH] = (0,1+x).x/(0,1-x) = 1,76.10-5. Giải pt thu được x, mà [H+] = x nên pH = -log[H+] = -log(x).
em cũng có thể dùng công thức pH= -LogKa + Log(Cb/Ca)
với Cb,Ca là nồng độ bazo và axit

Giải thích: Đáp án A
ne = It/ F = 5. 96,5.60/96500 = 0,3 (mol)
Tại catot (-) Tại anot (+)
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,5 a→ a → 0,5a 0,15 ← 0,3
2H2O + 2e → H2 + 2OH-
b → 0,5b

Nồng độ của CuSO4 = a = 0,2 M
