Điện phân dung dịch chứa 0,2 mol FeCl3; 0,1 mol CuCl2 và 0,15 mol HCl (điện cực trơ, màng ngăn xốp) với dòng điện I = 1,34A trong thời gian 12 giờ. Khi dừng điện phân thì khối lượng catot tăng:
A. 7,8g.
B. 6,4g
C. 9,2g
D. 11,2g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
Catot :
Fe3+ + 1e à Fe2+
Cu2+ + 2e à Cu
2H+ + 2e àH2
Fe2+ + 2e à Fe
, ne trao đổi = 0,6 mol
=> Theo thứ tự trên thì sau phản ứng có : 0,1 mol Cu và 0,025 mol Fe
=> mtăng = 0,1.64 + 0,025.56 = 7,8 g

t (s) ne trao đổi = 0,2.3+0,1.2=0,8 mol
=> 0,6t (s) ne trao đổi = 0,8.0,6=0,48 mol
Quá trình điện phân tại catot :
Fe3+ +e -> Fe2+
0,2 0,2
Cu2+ +2e -> Cu
0,1 0,2
Fe2+ +2e -> Fe
0,08 0,04
Khối lượng kim loại thu được ở catot là: m=0,1.64+0,04.56=8,64g
Đáp án D

Đáp án A
- Khí bắt đầu thoát ra ở catot là khi Fe3+, Cu2+ bị điện phân hết, H+ vừa bị điện phân
Phương trình điện phân:
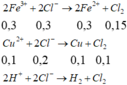
- Thêm dung dịch AgNO3 vừa đủ vào
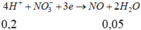
=> m Y =200+250-156,65-30.0,05-71.0,25=274,1 g
- Dung dịch Y Chứa 2 muối là: Fe(NO3)3 ; Cu(NO3)2
Muối có phân tử khối lớn hơn là Fe(NO3)3
C % Fe ( NO 3 ) 3 = 242 . 0 , 3 274 , 1 . 100 % = 26 , 49 % gần với giá trị 27 phút
Đáp án A
=> m = 0,1.64 + 0,025.56 = 7,8g