Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

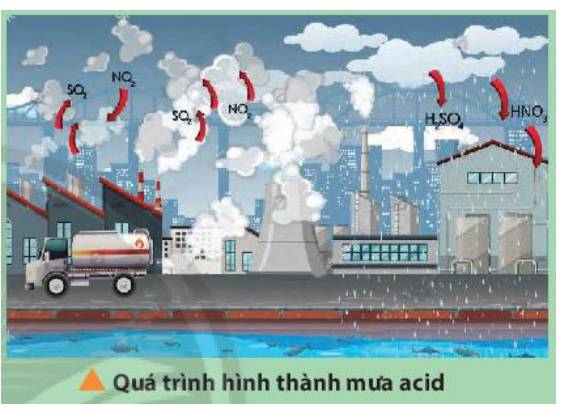
Nghiên cứu để tìm ra giải pháp nhằm giảm thiểu tác hại của mưa acid thuộc phương pháp nghiên cứu ứng dụng, nhằm mục đích giải quyết các vấn đề mưa acid gây nên (ảnh hưởng xấu đến môi trường, con người...)

- Chất tẩy rửa phổ biến là nước Javel gồm có NaCl và NaClO
=> Hai chất tác dụng với nhau để tạo thành nước Javel là: NaOH và Cl2
- Vì A ở dạng dung dịch, Y ở dạng khí
=> A là dung dịch NaOH, Y là khí Cl2
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
- Mà Y là khí Cl2
=> X là khí H2
a) Công thức hóa học của A, X, Y lần lượt là: NaOH, H2, Cl2
b) Phương trình hóa học
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g) (*)

a) Vì 2 nguyên tố có tổng số proton là 32
=> 2 nguyên tố thuộc chu kì nhỏ
Gọi 2 nguyên tố cần tìm trong A là X, Y
Vì hợp chất A tạo bởi 3 nguyên tử của 2 nguyên tố thuộc cùng 1 nhóm, ở 2 chu kì liên tiếp => CT của A : XY2
Ta có : \(\left\{{}\begin{matrix}Z_X+2Z_Y=32\\\left|Z_X-Z_Y\right|=8\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}Z_X=16\left(S\right)\\Z_Y=8\left(O\right)\end{matrix}\right.\)
=> CTPT của hợp chất : SO2
CT cấu tạo :
SO2 là liên kết cộng hóa trị có cực
b) Lưu huỳnh đioxit (SO2) mang đầy đủ tính chất hóa học của một oxit axit.
Tính chất hóa học của SO2:
- Tác dụng với nước tạo thành dung dịch axit.
Ví dụ: SO2 + H2O → H2SO3
- Tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ: SO2 + 2NaOH → Na2SO3 + H2O
- Tác dụng với oxit bazơ tạo thành muối.
Ví dụ: SO2 + Na2O → Na2SO3

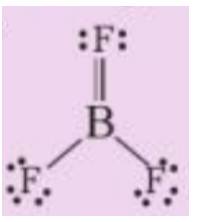
a) Phương trình hóa học: 2B + 3F2 → 2BF3
b) Trong phân tử BF3 có 2 liên kết đơn, 1 liên kết đôi (gồm 1 liên kết σ và 1 liên kết п)
=> Trong phân tử BF3 có 3 liên kết σ và 1 liên kết п

Sulfuric acid (H₂SO₄) được tạo thành từ: Cấu trúc: 1 nguyên tử lưu huỳnh (S) liên kết với 4 nguyên tử oxy (O) và 2 nguyên tử hydro (H). Liên kết hóa học: 2 liên kết đôi S=O (mỗi liên kết chứa 1 cặp electron). 2 liên kết đơn S-O (mỗi liên kết chứa 1 cặp electron). 2 liên kết O-H (mỗi liên kết chứa 1 cặp electron). Liên kết này tạo nên tính axit mạnh của sulfuric acid khi nó phân ly trong nước