Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lấy từng chất một mẫu thử:
- Cho lần lượt từng mẫu thử trên qua dung dịch nước vôi trong C a O H 2 dư, mẫu thử nào làm đục nước vôi trong đó là C O 2 :
C a O H 2 + C O 2 → C a C O 3 + H 2 O
- Lấy que đóm đầu có than hồng cho vào các mẫu thử còn lại, mẫu thử nào làm than hồng bùng cháy đó là oxi.
- Cho mẫu thử còn lại qua CuO nung nóng, khí nào đó có xuất hiện Cu ( màu đỏ). Đó là H 2 . Mẫu thử còn lại là không khí không làm đổi màu CuO.
C u O + H 2 → C u + H 2 O

Tham khảo:
Trích mẫu thử
Cho que đóm đang cháy vào các mẫu thử
- mẫu thử nào làm que đóm tắt là N2
- mẫu thử nào làm que đóm tiếp tục cháy là O2
- mẫu thử nào làm que đóm cháy với ngọn lửa màu xanh nhạt là H2

a. – Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
– Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
b. – Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao.
2KMnO4 ---t° → K2MnO4 + MnO2 + O2
2KClO3 ---t° → 2KCl + 3O2
– Khí O2 ít tan trong nước và nặng hơn không khí nên ta có thể thu O2 theo 2 cách: Đẩy nước và đẩy không khí.

Cho thử tàn que đóm:
- O2: que đóm bùng cháy
- N2, CO2, H2, CH4: không hiện tượng (1)
Dẫn (1) qua dd Ca(OH)2 dư:
- CO2: có kết tủa trắng
Ca(OH)2 + CO2 ---> CaCO3↓ + H2O
- N2, H2, CH4: không hiện tượng (2)
Dẫn (2) qua Fe2O3 nung nóng:
- H2: Làm chất rắn Fe2O3 màu đỏ nâu chuyển dần sang màu xám
- CH4, N2: không hiện tượng (3)
Dẫn (3) qua lọ Cl2 ngoài ánh sáng:
- CH4: Mất màu Cl2
CH4 + Cl2 --askt--> CH3Cl + HCl
- N2: không hiện tượng
Trích một ít mẫu thử và đánh dấu
Sục 5 khí qua dd Ca(OH)2
-CO2: xuất hiện kết tủa trắng
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
-\(N_2,O_2,H_2,CH_4\) : không hiện tượng
Sục 4 khí qua Cl2, có ánh sáng:
-CH4: dd clo mất màu
\(CH_4+Cl_2\rightarrow\left(ánh.sáng\right)CH_3Cl+HCl\)
-\(N_2,H_2,O_2\) : không hiện tượng
Đưa que đóm đang cháy vào 3 khí còn lại:
-O2: que đóm cháy mãnh liệt
-H2: cháy với ngọn lửa xanh, nổ nhẹ
-N2: que đóm vụn tắt đi

B1 : Cho 3 dd tác dụng với quỳ tím .
Chuyển đỏ -> HCl
Không chuyển màu -> KCl , K2SO4
B2 : Cho 2 dd còn lại tác dụng với Ba(OH)2
\(KCl+Ba\left(OH\right)_2\rightarrow BaCl_2+KOH\)
\(K_2SO_4+Ba\left(OH\right)_2\rightarrow KOH+BaSO_4\downarrow\)
Pư xuất hiện kết tủa trắng -> K2SO4

a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK

a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
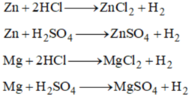
1) H2O \(\dfrac{điện-phân}{ }\)===> H2 + O2
HCl thường cho phản ứng vs Fe và Al vì chúng dễ kiếm :)))
PTFƯ: HCl + Fe ==> FeCl2 + H2
HCl + Al ===> Al2Cl3 + H2
H2SO4 thì cx có phản ứng vs kim loại tạo ra hidro nhưng người ta ít dùng
Câu 2)
Ta co the nhan biet N2; O2 ; H2 bằng cách
Đưa que đóm đang cháy vào 3 lọ Nitơ; Oxi ; Hidro
Nếu que đóm bùng cháy mạnh hơn thì đó là O2
Nếu que đóm đang cháy chuyển sang ngọn lửa màu xanh nhạt và tạo ra tiếng nổ nhỏ thì đó là H2.
Còn lại là khí Nitơ.
Câu 3)
Ta cho que đóm đang cháy vào 2 lọ
Nếu que đóm bùng cháy mạnh hơn thì đó là Oxi.
Con lai la Cacbonic ( CO2)
Câu 1)
Phương trình minh họa để điều chế H2.
Zn + 2HCl ----> ZnCl2 + H2
Fe + HCl -----> FeCl2 + H2