Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

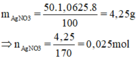
Phương trình hóa học của phản ứng:
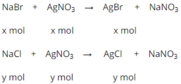
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Gọi nNaBr = x, nNaCl = y.
Theo pt: nNaBr = nAgNO3; nNaCl = nAgNO3
⇒ nNaBr + nNaCl = nAgNO3
Ta có hệ phương trình đại số: 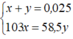
Giải ra, ta có x ≈ 0,009 mol
→ mNaBr = mNaCl = 103 x 0,009 = 0,927g
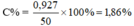

NaBr + AgNO3 \(\rightarrow\)AgBr + NaNO3
NaCl + AgNO3 \(\rightarrow\) AgCl + NaNO3
\(C_M=0,5M\Rightarrow n_{AgNO_3}=0,025\left(mol\right)\)
Gọi x, y lần lượt là số mol NaBr và NaCl
Ta có : x + y = 0,025
103x - 58,5y = 0
\(\Rightarrow x=9,0557.10^{-3};y=0,01594\)
\(\Rightarrow C\%=\frac{0,594.58,5}{50}.100\%=1,865\%\)
NaBr + AgNO3 →→AgBr + NaNO3
NaCl + AgNO3 →→ AgCl + NaNO3
CM=0,5M⇒nAgNO3=0,025(mol)CM=0,5M⇒nAgNO3=0,025(mol)
Gọi x, y lần lượt là số mol NaBr và NaCl
Ta có : x + y = 0,025
103x - 58,5y = 0
⇒x=9,0557.10−3;y=0,01594⇒x=9,0557.10−3;y=0,01594
⇒C%=0,594.58,550.100%=1,865%⇒C%=0,594.58,550.100%=1,865%

Chọn đáp án A
m d d A g N O 3 = V.D = 50.1,0625 = 53,125 (gam)
ð m A g N O 3 = 53 , 125 . 8 100 = 4,25 (gam) => n A g N O 3 = 4 , 25 170 = 0,025 (mol)
Nồng độ % của 2 muối bằng nhau => Khối lượng 2 muối bằng nhau.
N a C l : x m o l N a B r : y m o l → x + y = 0 , 025 58 , 5 x = 103 y → x = 0 , 0159 y = 0 , 0091
ð
C
%
N
a
C
l
=
0
,
0159.58
,
5
50
.100% = 1,86%

Phương trình hóa học của phản ứng:
NaBr + AgNO3 \(\rightarrow\) AgBr + NaNO3
NaCl + AgNO3 AgCl + NaNO3
Gọi nNaBr =x, nNaCl = y.
Có nAgNO3 = 50 x 1,0625 x 8 /100 x 170 = 0,025 mol.
=> x + y = 0,025
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dưng dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
=> 103x = 58,5y.
Giải hệ phương trình ta có x \(\approx\) 0,009 mol NaBr.
\(\Rightarrow\) mNaBr = mNaCl = 103 x 0,009 = 0,927g.
C% = 0,927 / 50 x 100% = 1,86%

11) Theo đề, ta có: \(n_{MnO_2}=\dfrac{78,3}{87}=0,9\left(mol\right)\)
PTHH: \(MnO_2+4HCl\rightarrow MnCl_2+2H_2O+Cl_2\left(1\right)\)
Số mol: 0,9 mol 3,6 mol 0,9 mol 1,8 mol 0,9 mol
a, Theo phương trình, ta có: \(n_{HCl}=4n_{MnO_2}=4.0,9=3,6\left(mol\right);n_{Cl_2}=n_{MnO_2}=0,9\left(mol\right)\)
\(\Rightarrow m_{HCl}=3,6.36,5=131,4\left(g\right)\)
Mặt khác, C% dung dịch HCl = \(\dfrac{m_{HCl}}{m_{ddHCl}}.100\%\) \(\Leftrightarrow20\%=\dfrac{131,4}{m_{ddHCl}}.100\%\Leftrightarrow m_{ddHCl}=\dfrac{131,4.100}{20}=657\left(g\right)\)(\(m_{ddHCl}\) là khối lượng dung dịch HCl).
\(V_{Cl_2}=0,9.22,4=20,16\left(l\right)\)
b, Theo phương trình, \(n_{MnCl_2}=n_{MnO_2}=0,9\left(mol\right)\)
\(\Rightarrow m_{MnCl_2}=0,9.126=113,4\left(g\right)\)
Mặt khác,
mdung dịch sau phản ứng = \(m_{MnCl_2}+\) mdung dịch HCl - \(m_{Cl_2}\)
= \(78,3+657-\left(0,9.35,5.2\right)\)
= 671,4 (g)
\(\Rightarrow C\%\)dung dịch \(MnCl_2\) = \(\dfrac{113,4}{671,4}.100\%=16,89\%\)
c, Theo (1), \(n_{Cl_2}=n_{MnCl_2}=0,9\left(mol\right)\)
PTHH: \(Fe+\dfrac{3}{2}Cl_2\rightarrow FeCl_3\left(2\right)\)
Số mol: 0,6 \(\rightarrow\) 0,9 \(\rightarrow\) 0,6
Theo (2) \(\Rightarrow n_{FeCl_3}=n_{Fe}=0,6\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=0.6.162,5=97,5\left(g\right)\)
\(\Rightarrow m\) dung dịch muối thu được = 97,5 + 52,5 =150 (g).
\(\Rightarrow C\%\)dung dịch \(FeCl_3\)= \(\dfrac{97,5}{150}.100\%=65\%\)

8/ Hoà tan một oxit của kim loại (có hoá trị không đổi) bằng dung dịch axit sunfuric có nồng độ 39,2 % vừa đủ thu được dung dịch muối có nồng độ 40,14%.
Tìm công thức của oxit trên.
Bài giải
Gọi x là hóa trị của kim loại
Giả sử khối lượng oxit tham gia pư là 1mol
R2Ox + xH2SO4 ----> R2 (SO4)x +x H2O
1mol x mol 1mol
mR2Ox=(2R+16x)g
mH2SO4=98x g
mddH2SO4=98x*100/39,2=250x g
mdd(spư)=2R+266x g
mR2(SO4)x=2R+96x g
Nồng độ muối sau pư:
(96x+2R)/(2R+266x)=40,14/100
\Leftrightarrow 119,72R=1077,24x
\Leftrightarrow R=9x
Ta thấy x=3, R=27 là thõa mãn
Vậy CT oxit là Al2O3

Phương trình hóa học của phản ứng:
NaBr + AgNO3 → AgBr↓ + NaNO3
X mol x mol x mol
NaCl + AgNO3 → AgCl↓ + NaNO3
Y mol y mol y mol
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Ta có hệ phương trình đại số:
Giải ra , ta có x = 0, 009 mol NaBr
→ mNaBr = mNaCl = 103 x 0,009 = 0,927g
C% = x 100% = 1,86%
x 100% = 1,86%